Contents
Kovalente Bindung
Eine kovalente Bindung , auch als molekulare Bindung bezeichnet, ist eine chemische Bindung, die die gemeinsame Nutzung von Elektronenpaaren zwischen Atomen beinhaltet. Diese Elektronenpaare und das stabile Gleichgewicht von anziehenden und abstoßenden Kräften zwischen Atomen, wenn sie Elektronen teilen, werden als kovalente Bindung bezeichnet.
Im Wassermolekül (H2O) besteht eine kovalente Bindung zwischen Sauerstoff und Wasserstoff. Jede der kovalenten Bindungen enthält zwei Elektronen, eines von einem Wasserstoffatom und eines vom Sauerstoffatom. Beide Atome teilen sich die Elektronen. Ein Wasserstoffmolekül H2 besteht aus zwei Wasserstoffatomen, die durch eine kovalente Bindung verbunden sind. Jedes Wasserstoffatom benötigt zwei Elektronen, um eine stabile äußere Elektronenhülle zu erhalten. Das Elektronenpaar wird von der positiven Ladung beider Atomkerne angezogen und hält das Molekül zusammen.
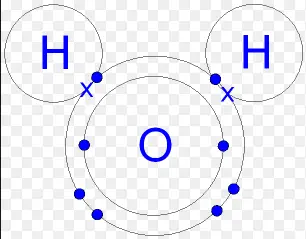
Metallische Bindung
Eine metallische Bindung ist eine Art chemischer Bindung, die zwischen positiv geladenen Atomen gebildet wird, bei der die freien Elektronen auf ein Kationengitter aufgeteilt werden. Metallische Bindungen werden in reinen Metallen und Legierungen und einigen Metalloiden beobachtet. Graphen (ein Allotrop von Kohlenstoff) weist beispielsweise eine zweidimensionale metallische Bindung auf. Auch reine Metalle können andere Arten von chemischen Bindungen zwischen ihren Atomen eingehen. Beispielsweise können die Quecksilberionen kovalente Metall-Metall-Bindungen bilden.
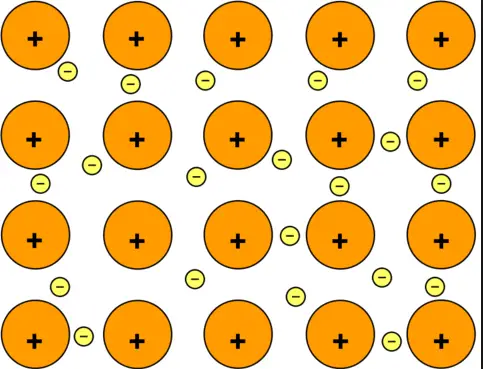
Die metallische Bindung kann als Folge davon angesehen werden, dass ein Material viel mehr delokalisierte Energiezustände hat als es delokalisierte Energiezustände als es delokalisierte Elektronen hat (Elektronenmangel), so dass lokalisierte ungepaarte Elektronen delokalisiert und mobil werden können. Die Elektronen können Energiezustände ändern und sich durch ein Gitter in jede Richtung bewegen. Metallische Bindungen können auch in Form einer metallischen Clusterbildung auftreten, bei der delokalisierte Elektronen um lokalisierte Kerne fließen.
Ionische Bindung
Ionenbindung ist eine Art der chemischen Bindung , die zwischen entgegengesetzt geladenen Ionen , und ist die primäre Wechselwirkung auftritt in ionischen Verbindungen , die die elektrostatische Anziehung umfaßt. Eine ionische Bindung wird durch Natriumchlorid in Kochsalz nachgewiesen . Das Natrium gibt dem Chlorid ein Elektron ab und bildet ein Paar geladener Ionen, wobei Natrium positiv und Chlorid negativ geladen ist. Die beiden entgegengesetzten Ladungen ziehen sich an und bilden eine sogenannte Ionenbindung.
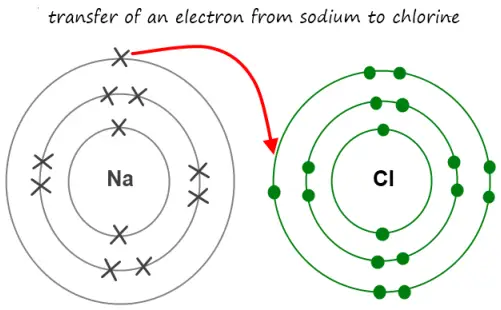
Ionische Verbindungen leiten Elektrizität, wenn sie geschmolzen oder in wässrigem Zustand sind. Sie haben auch einen hohen Schmelzpunkt, abhängig von der Ladung der Ionen, aus denen sie bestehen. Je höher die Ladung, desto stärker die Kohäsionskräfte und desto höher der Schmelzpunkt. Sie neigen auch dazu, in Wasser löslich zu sein, je stärker die Kohäsionskräfte, desto geringer die Löslichkeit.
Die wichtigsten Unterschiede
Beschreibung
- Kovalent : Eine kovalente Bindung ist eine Bindung, die entsteht, wenn eine starke elektrostatische Anziehungskraft zwischen positiv geladenen Kernen und einem gemeinsamen Elektronenpaar entsteht.
- Metallisch : Eine metallische Bindung ist eine Bindung, die gebildet wird, wenn eine starke elektrostatische Anziehungskraft zwischen Kationen oder Atomen und den delokalisierten Elektronen in der geometrischen Anordnung der beiden Metalle vorhanden ist.
- Ionisch : Eine ionische Bindung ist eine Bindung, die entsteht, wenn eine starke elektrostatische Anziehungskraft zwischen einem Kation und einem Anion (zwei entgegengesetzt geladene Ionen) von Elementen besteht.
Formation
- Kovalent : Eine kovalente Bindung wird zwischen zwei Nichtmetallen gebildet, die ähnliche Elektronegativitäten aufweisen (keiner der Atome ist stark genug, um Elektronen vom anderen anzuziehen. Zur Stabilisierung teilen sie ihre äußeren molekularen Valenzelektronen mit anderen.
- Metallisch : Metallische Bindungen bilden sich, wenn eine bestimmte Anzahl von Atomen eine variable Anzahl von Elektronen in einem Metallgitter teilt.
- Ionisch : Ionische Bindungen bilden sich, wenn ein Atom einem anderen Atom Elektronen zur Verfügung stellt.
Leitfähigkeit
- Kovalente Bindungen : Kovalent gebundene Atome sind schlechte Stromleiter.
- Metallische Bindungen : Atome mit metallischen Bindungen haben ausgezeichnete Wärme- und Elektrizitätsleiter.
- Ionenbindungen : Atome mit Ionenbindungen haben eine sehr geringe elektrische und thermische Leitfähigkeit.
Auftreten
- Kovalente Bindungen: Kovalente Bindungen treten zwischen zwei Nichtmetallen auf.
- Metallische Bindung : Metallische Bindung tritt zwischen zwei Metallen auf.
- Ionenbindungen : Ionenbindungen treten zwischen einem Metall und einem Nichtmetall auf.
Bindungsenergie
- Kovalente Bindungen : Die Bindungsenergie ist höher als die von metallischen Bindungen.
- Metallische Bindungen : Die Bindungsenergie ist niedriger als die von kovalenten und ionischen Bindungen.
- Ionische Bindungen : Die Bindungsenergie ist höher als die von metallischen Bindungen.
Duktilität
- Kovalente Bindungen : Materialien mit kovalenten Bindungen sind von Natur aus nicht duktil.
- Metallische Bindungen : Materialien mit metallischen Bindungen sind von Natur aus duktil.
- Ionische Bindungen : Materialien mit ionischen Bindungen sind von Natur aus nicht duktil.
Beispiele
- Kovalente Bindungen : Beispiele für Atome und Verbindungen mit kovalenten Bindungen sind: Wasserstoffgas, Stickstoffgas, Wassermoleküle, Diamant, Siliziumdioxid, Kohlenstoff usw.
- Metallische Bindungen : Beispiele für Elemente mit metallischen Bindungen sind: Silber, Blei, Kupfer, Eisen, Kalium, Natrium, Aluminium, Nickel, Kupfer, Silber usw.
- Ionische Bindungen : Beispiele für Verbindungen mit ionischen Bindungen sind: Magnesiumchlorid, Natriumchlorid, Kaliumchlorid, Lithiumiodid, Natriumflorid, Natriumbromid, Lithiumflorid usw.
Stärke
- Kovalente Bindungen : Kovalente Bindungen sind keine sehr starken Bindungen mit Ausnahme von Silizium, Diamant und Kohlenstoff.
- Metallische Bindungen : Metallische Bindungen sind sehr starke Bindungen.
- Ionische Bindungen : Ionische Bindungen sind aufgrund der kristallinen Natur sehr stark.
Formbarkeit
- Kovalente Bindungen : Materialien mit kovalenten Bindungen sind nicht verformbar.
- Metallische Bindungen: Materialien mit metallischen Bindungen sind verformbar.
- Ionenbindungen : Materialien mit Ionenbindungen sind nicht formbar.
Beinhaltet
- Kovalente Bindungen : Kovalente Bindungen beinhalten die gemeinsame Nutzung von Elektronen in der Valenzschale.
- Metallische Bindungen : Metallische Bindungen bewirken eine Anziehung zwischen den delokalisierten Elektronen, die im Gitter der Metalle vorhanden sind.
- Ionische Bindungen : Ionische Bindungen beinhalten die Übertragung und Aufnahme von Elektronen aus der Valenzschale.
Physikalischer Zustand bei Raumtemperatur
- Kovalente Bindungen : Kovalente Bindungen existieren in Verbindungen, die entweder in flüssigem, gasförmigem oder festem Zustand vorliegen.
- Metallische Bindungen : Metallische Bindungen existieren in Elementen, die nur im festen Zustand vorliegen.
- Ionische Bindungen : Ionische Bindungen existieren in Verbindungen, die nur im festen Zustand vorliegen.
Schmelz- und Siedepunkte
- Kovalente Bindungen: Verbindungen mit kovalenten Bindungen haben niedrigere Schmelz- und Siedepunkte.
- Metallische Bindungen : Metallische Bindungen haben hohe Schmelz- und Siedepunkte.
- Ionische Bindungen : Ionische Bindungen haben höhere Schmelz- und Siedepunkte.
Form
- Kovalente Bindungen : Kovalente Bindungen haben eine bestimmte Form.
- Metallische Bindungen : Metallische Bindungen haben keine bestimmte Form.
- Ionische Bindungen : Ionische Bindungen haben keine bestimmte Form.
Natur
- Kovalente Bindungen : Verbindungen mit kovalenten Bindungen sind relativ weich und wachsartig.
- Metallische Bindungen : Verbindungen mit metallischen Verbindungen sind relativ hart.
- Ionische Bindungen : Verbindungen mit ionischen Bindungen sind relativ hart.
Löslichkeit in unpolaren Lösungsmitteln
- Kovalente Bindungen : Verbindungen mit kovalenten Bindungen sind in unpolaren Lösungsmitteln leicht löslich.
- Metallische Bindungen : Verbindungen mit metallischen Bindungen sind in unpolaren Lösungsmitteln unlöslich.
- Ionische Bindungen : Verbindungen mit Metallbindungen sind in unpolaren Lösungsmitteln unlöslich.
Lesen Sie weiter: Unterschiede und Ähnlichkeiten zwischen kovalenten Bindungen und Wasserstoffbrücken
Kovalente Bindungen vs. Metallische Bindungen vs. Ionenbindungen in tabellarischer Form
| VERGLEICHSGRUNDLAGE | KOVALENTE ANLEITUNGEN | METALLISCHE VERBINDUNGEN | IONISCHE BINDUNGEN |
| Beschreibung | Eine kovalente Bindung ist eine Bindung, die entsteht, wenn eine starke elektrostatische Anziehungskraft zwischen positiv geladenen Kernen und einem gemeinsamen Elektronenpaar entsteht. | Eine metallische Bindung ist eine Bindung, die gebildet wird, wenn eine starke elektrostatische Anziehungskraft zwischen Kationen oder Atomen und den delokalisierten Elektronen in der geometrischen Anordnung der beiden Metalle vorhanden ist. | Ionenbindung ist eine Bindung, die entsteht, wenn eine starke elektrostatische Anziehungskraft zwischen einem Kation und einem Anion (zwei entgegengesetzt geladene Ionen) von Elementen besteht. |
| Formation | Eine kovalente Bindung wird zwischen zwei Nichtmetallen gebildet, die ähnliche Elektronegativitäten aufweisen (keines der Atome ist stark genug, um Elektronen vom anderen anzuziehen. | Metallische Bindungen bilden sich, wenn eine bestimmte Anzahl von Atomen eine variable Anzahl von Elektronen in einem Metallgitter teilt. | Ionenbindungen entstehen, wenn ein Atom einem anderen Atom Elektronen zur Verfügung stellt. |
| Leitfähigkeit | Kovalent gebundene Atome sind schlechte Stromleiter. | Atome mit metallischen Bindungen haben ausgezeichnete Wärme- und Elektrizitätsleiter. | Atome mit Ionenbindungen haben eine sehr geringe elektrische und thermische Leitfähigkeit. |
| Auftreten | Eine kovalente Bindung tritt zwischen zwei Nichtmetallen auf. | Metallische Bindungen treten zwischen zwei Metallen auf. | Eine Ionenbindung tritt zwischen einem Metall und einem Nichtmetall auf. |
| Bindungsenergie | Die Bindungsenergie ist höher als die von metallischen Bindungen. | Die Bindungsenergie ist niedriger als die von kovalenten und ionischen Bindungen. | Die Bindungsenergie ist höher als die von metallischen Bindungen. |
| Duktilität | Materialien mit kovalenten Bindungen sind von Natur aus nicht duktil. | Werkstoffe mit metallischen Bindungen sind duktiler Natur. | Materialien mit ionischen Bindungen sind von Natur aus nicht duktil. |
| Beispiele | Beispiele für Atome und Verbindungen mit kovalenten Bindungen sind : Wasserstoffgas, Stickstoffgas, Wassermoleküle, Diamant, Siliziumdioxid, Kohlenstoff usw. | Beispiele für Elemente mit metallischen Bindungen sind: Silber, Blei, Kupfer, Eisen, Kalium, Natrium, Aluminium, Nickel, Kupfer, Silber usw. | Beispiele für Verbindungen mit ionischen Bindungen sind: Magnesiumchlorid, Natriumchlorid, Kaliumchlorid, Lithiumiodid, Natriumflorid, Natriumbromid, Lithiumflorid usw. |
| Stärke | Kovalente Bindungen sind keine sehr starken Bindungen mit Ausnahme von Silizium, Diamant und Kohlenstoff. | Metallische Bindungen sind sehr starke Bindungen. | Ionenbindungen sind aufgrund der kristallinen Natur sehr stark. |
| Formbarkeit | Materialien mit kovalenten Bindungen sind nicht verformbar. | Materialien mit metallischen Bindungen sind verformbar. | Materialien mit Ionenbindungen sind nicht formbar. |
| Beinhaltet | Kovalente Bindungen beinhalten die gemeinsame Nutzung von Elektronen in der Valenzschale. | Metallische Bindungen bewirken eine Anziehung zwischen den delokalisierten Elektronen, die im Gitter der Metalle vorhanden sind. | Ionische Bindungen beinhalten die Übertragung und Aufnahme von Elektronen aus der Valenzschale. |
| Physikalischer Zustand bei Raumtemperatur | Kovalente Bindungen existieren in Verbindungen, die entweder in flüssigem, gasförmigem oder festem Zustand vorliegen. | Metallische Bindungen existieren in Elementen, die nur im festen Zustand vorliegen. | Ionische Bindungen existieren in Verbindungen, die nur im festen Zustand vorliegen. |
| Schmelz- und Siedepunkt | Verbindungen mit kovalenten Bindungen haben niedrigere Schmelz- und Siedepunkte. | Metallische Bindungen haben hohe Schmelz- und Siedepunkte. | Ionische Bindungen haben höhere Schmelz- und Siedepunkte. |
| Form | Kovalente Bindungen haben eine bestimmte Form. | Metallische Bindungen haben keine bestimmte Form. | Ionenbindungen haben keine bestimmte Form. |
| Natur | Verbindungen mit kovalenten Bindungen sind relativ weich und wachsartig. | Verbindungen mit metallischen Verbindungen sind relativ hart. | Verbindungen mit ionischen Bindungen sind relativ hart. |
| Löslichkeit | Verbindungen mit kovalenten Bindungen sind in unpolaren Lösungsmitteln gut löslich. | Verbindungen mit metallischen Bindungen sind in unpolaren Lösungsmitteln unlöslich. | Verbindungen mit metallischen Bindungen sind in unpolaren Lösungsmitteln unlöslich. |
