Eine kovalente Bindung, auch als molekulare Bindung bezeichnet, ist eine chemische Bindung, die die gemeinsame Nutzung von Elektronenpaaren zwischen Atomen beinhaltet. Diese Elektronenpaare werden als gemeinsame Paare oder Bindungspaare bezeichnet, und das stabile Gleichgewicht der anziehenden und abstoßenden Kräfte zwischen Atomen, wenn sie Elektronen teilen, wird als kovalente Bindung bezeichnet. Bei vielen Molekülen ermöglicht die gemeinsame Elektronenverteilung jedem Atom, die Äquivalenz einer vollständigen äußeren Schale zu erreichen, was einer stabilen elektronischen Konfiguration entspricht.
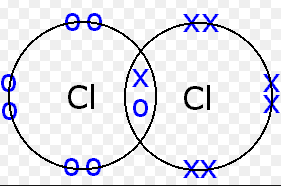
Ein Beispiel für eine kovalente Bindung ist die Cl-Cl-Bindung in einem Chloridmolekül. Zwei Chloridatome werden von demselben Elektronenpaar angezogen. Jedes Chloridatom hat sieben Valenzelektronen im dritten Energieniveau und benötigt ein weiteres Elektron, um einen Elektronenkern mit einer Argon-Elektronenkonfiguration zu bilden. Jedes Chloridatom trägt ein Elektron zu dem gebundenen Paar bei, das sich die beiden Atome teilen. Die verbleibenden sechs Valenzelektronen jedes Atoms sind nicht an der Bindung beteiligt.
Eine kovalente Bindung erfordert nicht unbedingt, dass die beiden Atome aus den gleichen Elementen bestehen, sondern nur, dass sie eine vergleichbare Elektronegativität aufweisen. Eine kovalente Bindung, bei der Elektronen auf mehr als zwei Atome verteilt werden, wird als delokalisiert bezeichnet.
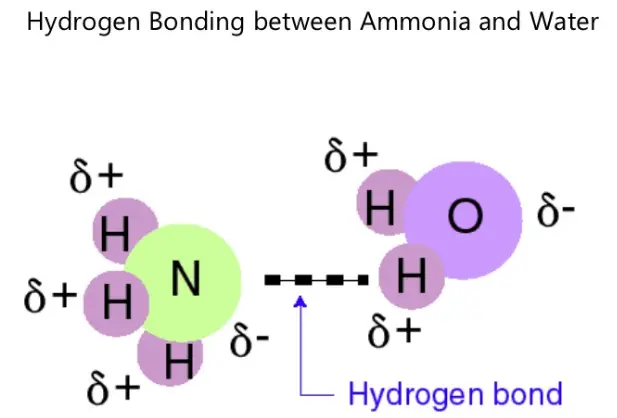
Wasserstoffbrücken hingegen treten auf, wenn ein Wasserstoffatom eine Dipol-Dipol-Anziehung zu einem elektronegativen Atom erfährt. Normalerweise treten Wasserstoffbrückenbindungen zwischen Wasserstoff und Fluor, Sauerstoff oder Stickstoff auf. Manchmal ist die Bindung intramolekular oder zwischen Atomen eines Moleküls statt zwischen Atomen separater Moleküle (intermolekular).
Ein Beispiel für ein Molekül, das Wasserstoffbrückenbindungen aufweist, ist Ammoniak (NH3). Wasserstoffbrückenbindungen bilden sich zwischen Wasserstoff eines Moleküls und Stickstoff eines anderen. Bei Ammoniak ist die Bindung sehr schwach, da jeder Stickstoff ein einsames Elektronenpaar besitzt.
Lesen Sie weiter: Kovalent vs. Metallisch vs. Ionenverbindung
Kovalente Bindungen vs. Wasserstoffbrücken in Tabellenform
| VERGLEICHSGRUNDLAGE | KOVALENTE ANLEITUNGEN | WASSERSTOFFBRÜCKEN |
| Beschreibung | Kovalente Bindungen sind chemische Bindungen, die durch die gemeinsame Nutzung von Elektronen zwischen Atomen gebildet werden. | Wasserstoffbrückenbindungen sind chemische Bindungen, die durch elektrostatische Anziehungskräfte zwischen Wasserstoff und einem elektronegativen Atom wie O, N und F gebildet werden. |
| Bindungsbestandteile | Die kovalente Bindung verändert die chemischen Eigenschaften der Bindungsbestandteile. | Wasserstoffbrückenbindungen verändern die physikalischen Eigenschaften von Bindungsbestandteilen. |
| Haftfestigkeit | Eine kovalente Bindung ist eine starke Bindung. Die Bindungsenergie kovalenter Bindungen liegt zwischen 100 und 110 kj/mol. | Wasserstoffbrückenbindung ist eine schwache Bindung. Die Bindungsenergie der Wasserstoffbrückenbindung liegt zwischen 5 und 50 kj/mol. |
| Auftreten | Kovalente Bindungen können zwischen polaren und unpolaren Atomen oder Molekülen auftreten. | Die Bildung von Wasserstoffbrücken kann nur in polaren Molekülen auftreten. |
| Stärke | Die Kovalenz ist größer, wenn die gebundenen Atome eine ähnliche Elektronegativität aufweisen. | Die Stärke der Wasserstoffbindung nimmt mit zunehmender Elektronegativitätsdifferenz zwischen Wasserstoff und dem gebundenen Atom zu. |
| Kategorie der Anleihe | Die kovalente Bindung kann als primäre Bindung kategorisiert werden. | Wasserstoffbrückenbindung kann als sekundäre Bindung kategorisiert werden. |
| Art der Bindung | Die Natur der kovalenten Bindung ist eine intramolekulare Bindung. | Die Natur der Wasserstoffbrückenbindung ist eine intermolekulare Bindung (und nicht intramolekular). |
| Bindungsbildung | Kovalente Bindungen können nur zwischen Atomen mit geeigneter Elektronenvalenz gebildet werden. | Wasserstoffbrückenbindungen können nur zwischen Wasserstoff und einem elektronegativen Atom auftreten. |
| Atoms äußere Ortbitale | Die kovalente Bindungsbildung erfüllt die Wertigkeit der äußeren Orbitale in einem Atom. | Die Bildung von Wasserstoffbrücken erfüllt nicht die Wertigkeit des äußeren Orbitals des Atoms. |
| Beispiele | Beispiel für eine kovalente Bindung ist die Bindung zwischen Wasserstoff und Sauerstoff im Wassermolekül. | Beispiel für Wasserstoffbrückenbindung: Wechselwirkung zwischen zwei DNA-Strängen und Wechselwirkung zwischen Wassermolekülen und Eis. |
Was sind einige der Ähnlichkeiten von Wasserstoff- und kovalenten Bindungen?
- Sowohl kovalente als auch Wasserstoffbrücken sind Formen intermolekularer Kräfte.
- Kovalente und Wasserstoffbrückenbindungen sind Arten von chemischen Bindungen.
- Zwischen zwei Atomen treten sowohl kovalente als auch Wasserstoffbrücken auf.
- Beide Arten von Bindungen (kovalent und Wasserstoff) wirken als Klebstoff zwischen zwei Atomen.ğ