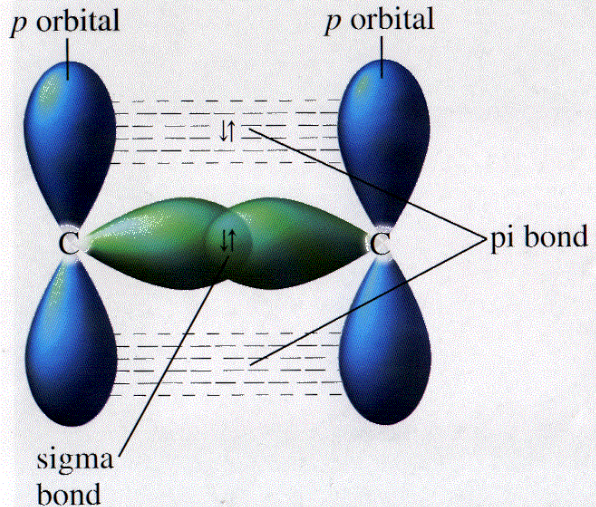
Pi-Bond & Sigma-Bond
Eine Pi-Bindung ist eine kovalente Bindung, die durch die seitliche Überlappung zweier Atomorbitale gebildet wird. Jedes dieser Atomorbitale hat eine Elektronendichte von null an einer gemeinsamen Knotenebene, die durch die beiden verbundenen Kerne geht. Dieselbe Ebene ist auch eine Knotenebene für das Molekülorbital der pi-Bindung.
Eine Sigma-Bindung ist eine kovalente Bindung, die vom Kopf bei Überlappung zweier Atomorbitale gebildet wird. Sigma-Bindung kann eine antibindende Wechselwirkung oder eine bindende Wechselwirkung sein (bindende Wechselwirkung entsteht durch Überlappung zweier Atomorbitale in derselben Phase, während antibindende Wechselwirkung durch Überlappung in entgegengesetzter Phase auftritt).
Sigma-Bindungen sind aufgrund der direkten Überlappung der Orbitale die stärkste Art von kovalenten Bindungen, und die Elektronen in diesen Bindungen werden manchmal als Sigma-Elektronen bezeichnet. Typischerweise ist eine Einfachbindung eine Sigma-Bindung, während eine Mehrfachbindung aus einer Sigma-Bindung zusammen mit pi oder anderen Bindungen besteht, zum Beispiel in einem Stickstoffmolekül (N2) besteht die Dreifachbindung zwischen den beiden Stickstoffatomen aus einer Sigma-Bindung und zwei Pi-Bindungen.
Pi-Anleihen sind oft schwächer als Sigma-Anleihen. Die CC-Doppelbindung, die aus einer Sigma- und einer Pi-Bindung besteht, hat eine Bindungsenergie, die weniger als das Doppelte einer CC-Einfachbindung beträgt, was darauf hindeutet, dass die durch die Pi-Bindung hinzugefügte Stabilität geringer ist als die Stabilität einer Sigma-Bindung. Unten ist ein detaillierter Vergleich zwischen einer Pi-Bindung und einer Sigma-Bindung.
Die wichtigsten Unterschiede
- Sigma-Bindungen sind Bindungen zwischen Atomen innerhalb von Molekülen, die entlang der Achse gebildet werden, die die gebundenen Kerne der Atome verbindet. Auf der anderen Seite sind Pi-Bindungen Bindungen zwischen Atomen innerhalb von Molekülen, bei denen sich die Elektronen oberhalb und unterhalb der Achse befinden, die die Kerne der verbundenen Atome verbindet, aber nicht entlang der Achse. Sie sind die zweite Art von Bindung, die sich innerhalb eines Moleküls nach der Sigma-Bindung bildet.
- Pi-Bindungen werden aus der Kombination von p- und ähnlichen Orbitalen in verschiedenen Atomen gebildet, während Sigma-Bindungen oft durch die Kombination von s- Orbitalen in verschiedenen Atomen gebildet werden.
- Die Pi-Bindung wird durch die Überlappung von Atomorbitalen gebildet, während die Sigma-Bindung gebildet wird, wenn der Kopf der Atomorbitale entlang der internuklearen Achse der Atome miteinander überlappt.
- Die Pi-Bindung ist eine schwächere Art der kovalenten Bindung im Vergleich zur Sigma-Bindung, die die stärkste Art der kovalenten Bindung zwischen zwei Atomen ist. Dies liegt daran, dass die Überlappung der Pi-Bindung in geringerem Maße auftritt und die Bindung daher schwach ist. Beim Sigma-Bond findet die Überlappung in größerem Maße statt und es entsteht daher ein starker Verbund.
- Eine einzelne Pi-Bindung enthält nur eine Pi-Bindung, während Mehrfachbindungen wie Doppelbindungen zwei Pi-Bindungen und Dreifachbindungen drei Pi-Bindungen haben. Auf der anderen Seite enthält eine Einfachbindung einer Sigma-Bindung nur eine Sigma-Bindung, während Mehrfachbindungen wie eine Doppelbindung nur eine Sigma-Bindung enthalten.
- Die Pi-Bindung kann sich nicht symmetrisch um eine internukleare Rotation drehen, während eine Sigma-Bindung symmetrisch um die internukleare Achse rotieren kann.
- Pi-Bindungen bestimmen die Länge des Moleküls, während die Sigma-Bindung die Form des Moleküls bestimmt.
- Bei der Pi-Bindung ist die Relativität der gebildeten Verbindung direkt proportional zu einigen Pi-Bindungen, während die Stabilität der Verbindung umgekehrt proportional zur Anzahl der Pi-Bindungen ist. Im Gegensatz dazu ist bei der Sigma-Bindung die Relativität der gebildeten Verbindung umgekehrt proportional zu einigen Sigma-Bindungen, während die Stabilität der Verbindung direkt proportional zur Anzahl der Sigma-Bindungen ist.
- An der Bildung der Pi-Bindung können s- Orbitale nicht teilnehmen, während an der Bildung der Sigma-Bindung S- Orbitale teilnehmen können.
- Bei Pi-Bindungen sind die Molekülorbitale diskontinuierlich und bestehen aus zwei geladenen Wolken oberhalb und unterhalb der Atomebene. Andererseits ist bei der Sigma-Bindung das Molekülorbital symmetrisch zur intermolekularen Achse.
- Pi-Bindungen sind weniger reaktiv, während Sigma-Bindungen reaktiver sind.
- Der Bildung von Pi-Bindungen geht die Bildung von Sigma-Bindungen voraus. Auf der anderen Seite werden, wenn sich Atome näher kommen, zuerst Sigma-Bindungen gebildet.
Lesen Sie auch: Unterschied zwischen kovalenter, metallischer und ionischer Bindung
Pi-Bond vs. Sigma-Anleihe in Tabellenform
| VERGLEICHSGRUNDLAGE | Pi BOND | SIGMA-BOND |
| Beschreibung | Pi-Bindungen sind Bindungen zwischen Atomen innerhalb von Molekülen, bei denen sich die Elektronen oberhalb und unterhalb der Achse befinden, die die Kerne der verbundenen Atome verbindet, jedoch nicht entlang der Achse. | Sigma-Bindungen sind Bindungen zwischen Atomen innerhalb von Molekülen, die entlang der Achse gebildet werden, die die gebundenen Kerne der Atome verbindet. |
| Formation | Gebildet aus der Kombination von p und ähnlichen Orbitalen in verschiedenen Atomen. | Wird oft durch die Kombination von s- Orbitalen in verschiedenen Atomen gebildet. |
| Formation | Gebildet durch die Überlappung von Atomorbitalen. | Entsteht, wenn sich der Kopf der Atomorbitale entlang der internuklearen Achse der Atome überlappt. |
| Stärke | Die Pi-Bindung ist im Vergleich zur Sigma-Bindung eine schwächere Art der kovalenten Bindung. | Die Sigma-Bindung ist im Vergleich zur Pi-Bindung eine stärkere Art von kovalenter Bindung. |
| Anzahl Anleihen | Eine einzelne Pi-Bindung enthält nur eine Pi-Bindung, während Mehrfachbindungen wie Doppelbindungen zwei Pi-Bindungen und Dreifachbindungen drei Pi-Bindungen haben. | Eine Einfachbindung einer Sigma-Bindung enthält nur eine Sigma-Bindung, während Mehrfachbindungen wie eine Doppelbindung nur eine Sigma-Bindung enthalten. |
| Symmetrische Drehung | Die Pi-Bindung kann sich nicht symmetrisch um einen Zwischenkern drehen. | Eine Sigma-Bindung kann symmetrisch um die internukleare Achse rotieren. |
| Einfluss von auf die Länge des Moleküls | Pi-Bindungen bestimmen die Länge des Moleküls. | Die Sigma-Bindung bestimmt die Form des Moleküls. |
| Relativität der gebildeten Verbindung | Bei der Pi-Bindung ist die Relativität der gebildeten Verbindung direkt proportional zu einigen Pi-Bindungen, während die Stabilität der Verbindung umgekehrt proportional zur Anzahl der Pi-Bindungen ist. | Bei der Sigma-Bindung ist die Relativität der gebildeten Verbindung umgekehrt proportional zu einigen Sigma-Bindungen, während die Stabilität der Verbindung direkt proportional zur Anzahl der Sigma-Bindungen ist. |
| s-Orbitale | An der Bildung der Pi-Bindung können s- Orbitale nicht teilnehmen. | An der Bildung der Sigma-Bindung können S- Orbitale teilnehmen. |
| Molekülorbital | Bei Pi-Bindungen sind die Molekülorbitale diskontinuierlich und bestehen aus zwei geladenen Wolken oberhalb und unterhalb der Atomebene. | Bei der Sigma-Bindung ist das Molekülorbital symmetrisch zur intermolekularen Achse. |
| Reaktivität | Pi-Bindungen sind weniger reaktiv. | Sigma-Anleihen sind reaktiver. |
| Welches wird zuerst gebildet? | Der Bildung von Pi-Bindungen geht die Bildung von Sigma-Bindungen voraus. | Wenn sich Atome näher kommen, werden zuerst Sigma-Bindungen gebildet. |