Die Valenzbindungstheorie ist eine molekulare Theorie, die verwendet wird, um die chemische Bindung von Atomen in einem Molekül zu definieren. Die Valenzbindungstheorie basiert auf dem Ansatz lokalisierter Bindungen, bei dem angenommen wird, dass die Elektronen in einem Molekül Atomorbitale für die einzelnen Atome besetzen. Als chemische Bindungstheorie erklärt sie, dass die Bindung zwischen zwei Atomen durch die Überlappung halb gefüllter Atomorbitale verursacht wird. Die beiden Atome teilen sich das ungepaarte Elektron des anderen, um ein gefülltes Orbital zu bilden, um ein Hybridorbital zu bilden und sich miteinander zu verbinden. Sigma- und Pi-Bindungen sind Teil der Valenzbindungstheorie. Die Valenzbindungstheorie wurde erstmals 1927 von W. Heitler und F. London vorgeschlagen
Im Gegensatz dazu ist die Molekülorbitaltheorie eine grundlegende Theorie, die verwendet wird, um die chemische Bindung eines Moleküls unter Verwendung hypothetischer Molekülorbitale zu definieren. Die Molekülorbitaltheorie ist eine Methode, die Struktur eines Moleküls zu betrachten, indem Molekülorbitale verwendet werden, die zum Molekül als Ganzes gehören und nicht zu den einzelnen Atomen.
Wenn zwischen zwei Atomen eine einfache Bindung auftritt, besetzt das die Bindung bildende Elektronenpaar ein Molekülorbital, das eine mathematische Kombination der Wellenfunktionen der Atomorbitale der beiden beteiligten Atome ist. Die Molekülorbitaltheorie wurde erstmals 1932 von F. Hund und RS Mulliken vorgeschlagen .
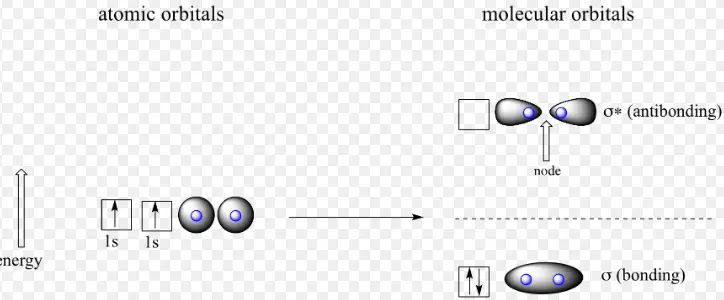
Hauptunterschiede
- Die Valenzbindungstheorie wurde erstmals 1927 von W. Heitler und F. London vorgeschlagen, während die Molekülorbitaltheorie erstmals 1932 von F. Hund und RS Mulliken vorgeschlagen wurde.
- Die Valenzbindungstheorie definiert die Hybridisierung von Molekülorbitalen, während die Molekültheorie nichts über die Hybridisierung von Orbitalen definiert.
- Die Valenzbindungstheorie kann nur auf zweiatomige Moleküle angewendet werden, während die Molekülorbitaltheorie auf mehratomige Moleküle angewendet werden kann.
- In der Valenzbindungstheorie sind Bindungen an zwei Atome und nicht an Molekülen lokalisiert, während in der Molekülorbitaltheorie Bindungen sowohl an zwei Atomen als auch an Molekülen lokalisiert sind.
- Die Valenztheorie erklärt, dass Moleküle Atomorbitale besetzen, während die Molekülorbitaltheorie die Vermischung von Atomorbitalen bei der Bildung von Molekülen erklärt.
- In der Valenzbindungstheorie spielt Resonanz eine wichtige Rolle, während Resonanz in der Molekülorbitaltheorie keine Rolle spielt.
- In der Valenzbindungstheorie behalten Atome, die an der Bindungsbildung beteiligt sind, ihre individuelle charakteristische Natur. Im Gegensatz dazu behalten in der Molekülorbitaltheorie Atomorbitale, die Molekülorbitale bilden, ihre individuelle charakteristische Natur nicht bei.
- In der Valenzbindungstheorie gibt es keine Erklärung für den paramagnetischen Charakter von Sauerstoff, während es in der Molekülorbitaltheorie eine ausführliche Erklärung für den paramagnetischen Charakter von Sauerstoff gibt.
- In der Valenzbindungstheorie wird das resultierende Molekülorbital durch die Kombination zweier Wellenfunktionen zweier ungepaarter Elektronen erhalten. Andererseits basiert die Bildung der Molekülorbitale in der Molekülorbitaltheorie auf der LCAO-Näherungsmethode, wobei Atomorbitale, die der Valenzschale von zwei entsprechen, nur an der Bildung von Molekülorbitalen beteiligt sind.
- In der Valenzbindungstheorie werden einige der Valenzelektronen als nicht geteilt und nicht an der Bildung des Moleküls beteiligt dargestellt. Im Gegensatz dazu werden in der Molekülorbitaltheorie alle Elektronen der Valenzschale als an der Bindung beteiligt dargestellt.
- Die Valenzbindungstheorie ist besonders in Bezug auf Berechnungen einfach und bequem, während die Molekülorbitaltheorie insbesondere in Bezug auf Berechnungen irgendwie komplex und mühsam ist.
LESEN SIE AUCH : Bonding vs. Antibindende Molekülorbitale
Valenzbindungstheorie (VBT) vs. Molekülorbitaltheorie (MOT) in Tabellenform
| VERGLEICHSGRUNDLAGE | VALENCE BOND THEORIE (VBT) | MOLEKULARORBITALTHEORIE (MOT) |
| Beschreibung | Die Valenzbindungstheorie ist eine molekulare Theorie, die verwendet wird, um die chemische Bindung von Atomen in einem Molekül zu definieren. Die Valenzbindungstheorie basiert auf dem Ansatz lokalisierter Bindungen, bei dem angenommen wird, dass die Elektronen in einem Molekül Atomorbitale für die einzelnen Atome besetzen. | Die Molekülorbitaltheorie ist eine grundlegende Theorie, die verwendet wird, um die chemische Bindung eines Moleküls unter Verwendung hypothetischer Molekülorbitale zu definieren. Die Molekülorbitaltheorie ist eine Methode, die Struktur eines Moleküls zu betrachten, indem Molekülorbitale verwendet werden, die zum Molekül als Ganzes gehören und nicht zu den einzelnen Atomen. |
| Vorgeschlagen von | Die Valenzbindungstheorie wurde erstmals 1927 von W. Heitler und F. London vorgeschlagen. | Die Molekülorbitaltheorie wurde erstmals 1932 von F. Hund und RS Mulliken vorgeschlagen. |
| Anwendung | Es kann nur für zweiatomige Moleküle angewendet werden. | Es kann auf mehratomige Moleküle angewendet werden. |
| Bindungslokalisierung | In der Valenzbindungstheorie sind Bindungen an zwei Atome und nicht an Molekülen lokalisiert. | In der Molekülorbitaltheorie sind Bindungen sowohl an zwei Atome als auch an Moleküle lokalisiert. |
| Was die Theorie erklärt | Die Theorie erklärt Moleküle, die Atomorbitale besetzen. | Die Theorie erklärt die Vermischung von Atomorbitalen bei der Bildung von Molekülen. |
| Resonanz | In der Valenzbindungstheorie spielt Resonanz eine wichtige Rolle. | In der Molekülorbitaltheorie spielt Resonanz keine Rolle. |
| Beibehaltung individueller Merkmale | Atome, die an der Bindungsbildung beteiligt sind, behalten ihre individuelle charakteristische Natur. | Atomorbitale, die Molekülorbitale bilden, behalten ihre individuelle charakteristische Natur nicht. |
| Erklärung des paramagnetischen Charakters von Sauerstoff | Es gibt keine Erklärung für den paramagnetischen Charakter von Sauerstoff. | Es gibt eine ausführliche Erklärung für den paramagnetischen Charakter von Sauerstoff. |
| Formation | Das resultierende Molekülorbital wird durch die Kombination zweier Wellenfunktionen zweier ungepaarter Elektronen erhalten. | Die Bildung der Molekülorbitale basiert auf der LCAO-Näherungsmethode, wobei Atomorbitale, die der Valenzschale von zwei entsprechen, nur an der Bildung von Molekülorbitalen beteiligt sind. |
| Darstellung von Valenzelektronen | Einige der Valenzelektronen werden als nicht geteilt dargestellt und sind nicht an der Bildung des Moleküls beteiligt. | Alle Elektronen der Valenzschale werden als an der Bindung beteiligt dargestellt. |
| Komplexität | Die Valenzbindungstheorie ist besonders in Bezug auf Berechnungen einfach und bequem. | Die Molekülorbitaltheorie ist irgendwie komplex und langwierig, insbesondere was die Berechnungen angeht. |

