Contents
Was ist ein ideales Gas?
Ein ideales Gas ist ein hypothetisches Gas, dessen Moleküle keine intermolekularen Anziehungskräfte aufweisen und eine elastische Kollision miteinander und mit den Wänden des Behälters erfahren. Ein ideales Gas entspricht einer bestimmten idealisierten Beziehung zwischen Druck, Volumen und Temperatur, die als ideales Gasgesetz bezeichnet wird. Das ideale Gasgesetz geht davon aus, dass sich alle Gase perfekt und identisch mit den Regeln der kinetischen Molekültheorie verhalten.
Alle Gase werden auf der Annahme der kinetischen Theorie der Materie modelliert, die davon ausgeht, dass alle Materie aus Teilchen (dh Atomen oder Molekülen) besteht; Zwischen diesen Partikeln gibt es Zwischenräume und die Anziehungskräfte werden stärker, wenn die Partikel konvergieren. Partikel befinden sich in ständiger, zufälliger Bewegung und kollidieren miteinander und mit den Wänden des Behälters, in dem sie eingeschlossen sind. Jedes Teilchen hat eine inhärente kinetische Energie, die nur von der Temperatur abhängt.
Als ideal gilt ein Gas, wenn seine Teilchen so weit voneinander entfernt sind, dass sie keine Anziehungskräfte aufeinander ausüben. Im wirklichen Leben gibt es kein wirklich ideales Gas, sondern bei hohen Temperaturen und niedrigen Drücken (Bedingungen, bei denen sich einzelne Teilchen sehr schnell bewegen und sehr weit voneinander entfernt sind, sodass ihre Wechselwirkung nahezu null ist).
Eigenschaften des idealen Gases
- Ein ideales Gas ist ein hypothetisches Gas, das in der Umgebung nicht wirklich existiert. Alternativ kann ein ideales Gas als ein Gas beschrieben werden, das alle Annahmen der kinetischen Molekültheorie erfüllt.
- Ideale Gase gehorchen allen Gasgesetzen unter allen Temperatur- und Druckbedingungen.
- Das von den Molekülen eingenommene Volumen ist im Vergleich zum Gesamtvolumen des Gases vernachlässigbar. Mit anderen Worten, die Teilchen haben kein bestimmtes Volumen und keine bestimmte Masse.
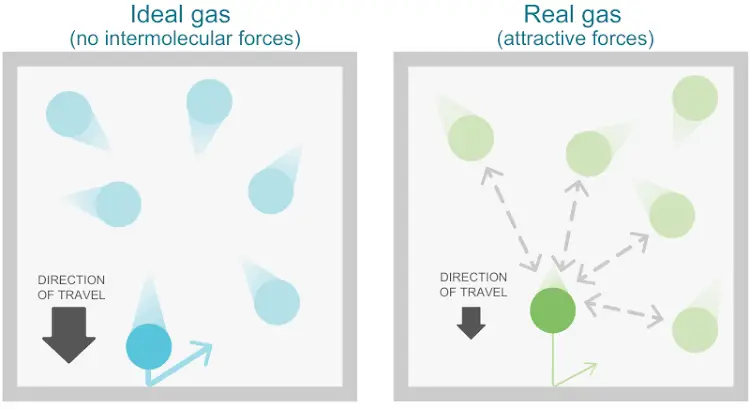
- Zwischen den Molekülen sind keine intermolekularen Anziehungskräfte vorhanden.
- Teilchen des idealen Gases haben eine elastische Kollision zwischen Molekülen.
- Es gehorcht der idealen Gasgleichung PV=nRT.
- Ein ideales Gas kann sich bei hohem Druck und niedrigen Temperaturen wie ein echtes Gas verhalten.
- Das ideale Gasgesetz geht davon aus, dass sich alle Gase perfekt und identisch mit den Regeln der kinetischen Molekültheorie verhalten.
Was ist ein echtes Gas?
Ein reales Gas, auch als nichtideales Gas bezeichnet, sind gasförmige Verbindungen, deren Moleküle Raum einnehmen, Wechselwirkungen mit intermolekularen Anziehungskräften zwischen den Molekülen des Gases aufweisen. Das vom Molekül eingenommene Volumen ist im Vergleich zum Gesamtvolumen des Gases nicht zu vernachlässigen. Mit anderen Worten, die Teilchen haben ein bestimmtes Volumen und eine bestimmte Masse. Folglich folgen reale Gase nicht dem idealen Gasgesetz. Sie gehorchen dem idealen Gasgesetz nur bei niedrigem Druck oder hoher Temperatur.
Jedes vorhandene Gas ist ein echtes Gas. Beispiele für echtes Gas sind: Stickstoff, Sauerstoff, Wasserstoff, Kohlendioxid und Helium. Echte Gase können bei niedrigen Temperaturen und hohem Druck flüssig und fest werden.
Eigenschaften von Echtgas
- Ein echtes Gas ist eine gasförmige Verbindung, die tatsächlich in der Umwelt vorkommt.
- Reale Gase gehorchen nur bei niedrigen Drücken und hohen Temperaturen den Gasgesetzen.
- Das vom Molekül eingenommene Volumen ist im Vergleich zum Gesamtvolumen des Gases nicht zu vernachlässigen. Mit anderen Worten, die Teilchen haben ein bestimmtes Volumen und eine bestimmte Masse.
- Zwischen den Molekülen des Gases sind intermolekulare Anziehungskräfte vorhanden.
- Teilchen aus echtem Gas haben nichtelastische Kollisionen zwischen Molekülen.
- Es gehorcht der Van-der-Waals-Gleichung (P +an 2 /V 2 ) (v-nb)=nRT.
- Ein reales Gas kann sich bei niedrigem Druck und hohen Temperaturen wie ein ideales Gas verhalten.
- Echte Gase können bei niedrigen Temperaturen und hohem Druck flüssig und fest werden.
- Beispiele für echtes Gas sind: Stickstoff, Sauerstoff, Wasserstoff, Kohlendioxid und Helium.
Unterschied zwischen Realgas und Idealgas in Tabellenform
| VERGLEICHSGRUNDLAGE | ECHTES GAS | IDEALES GAS |
| Beschreibung | Ein echtes Gas ist eine gasförmige Verbindung, die tatsächlich in der Umwelt vorkommt. | Ein ideales Gas ist ein hypothetisches Gas, das in der Umgebung nicht wirklich existiert. |
| Gasgesetze | Reale Gase gehorchen nur bei niedrigen Drücken und hohen Temperaturen den Gasgesetzen. | Ideale Gase gehorchen allen Gasgesetzen unter allen Temperatur- und Druckbedingungen. |
| Volumen | Das vom Molekül eingenommene Volumen ist im Vergleich zum Gesamtvolumen des Gases nicht zu vernachlässigen. | Das von den Molekülen eingenommene Volumen ist im Vergleich zum Gesamtvolumen des Gases vernachlässigbar. |
| Intermolekulare Anziehungskräfte | Zwischen den Molekülen des Gases sind intermolekulare Anziehungskräfte vorhanden. | Zwischen den Molekülen sind keine intermolekularen Anziehungskräfte vorhanden. |
| Kollisionen von Partikeln | Teilchen aus echtem Gas haben nichtelastische Kollisionen zwischen Molekülen. | Teilchen des idealen Gases haben eine elastische Kollision zwischen Molekülen. |
| Gleichung | Es gehorcht der Van-der-Waals-Gleichung (P +an 2 /V 2 ) (v-nb)=nRT. | Es gehorcht der idealen Gasgleichung PV=nRT. |
| Verhalten | Ein reales Gas kann sich bei niedrigem Druck und hohen Temperaturen wie ein ideales Gas verhalten. | Ein ideales Gas kann sich bei hohem Druck und niedrigen Temperaturen wie ein echtes Gas verhalten. |
| Temperatur & Druck | Echte Gase können bei niedrigen Temperaturen und hohem Druck flüssig und fest werden. | Das ideale Gasgesetz geht davon aus, dass sich alle Gase perfekt und identisch mit den Regeln der kinetischen Molekültheorie verhalten. |
