Erfahren Sie den Unterschied zwischen exothermer und endothermer Reaktion. Vergleichsgrundlagen sind: Beschreibung, Herstellung, Enthalpieänderung, Endproduktstabilität, Temperatur, Beispiele und Energie.
Contents
Was ist eine exotherme Reaktion?
Exotherme Reaktionen sind Reaktionen oder Prozesse, die Energie, meist in Form von Wärme oder Licht, an ihre Umgebung abgeben. Beispiele für exotherme Reaktionen sind:
- Thermit-Reaktion
- Neutralisationsreaktion (Mischen von Base und Säure).
- Verbrennung von Kraftstoff.
- Atmung
- Kernspaltung
- Korrosion von Metall
- Auflösen einer Säure in Wasser.
Was ist eine endotherme Reaktion?
Endotherme Reaktionen sind Reaktionen, die externe Energie, meist in Form von Wärme, benötigen, damit die Reaktion abläuft. Da sie Wärme aus ihrer Umgebung aufnehmen, neigen sie dazu, ihre Umgebung abzukühlen. Beispiele für endotherme Reaktionen sind:
- Auflösen von Ammoniumchlorid in Wasser.
- Knackende Alkane
- Photosynthese
- Schmelzendes Eis
- Verdunsten von flüssigem Wasser
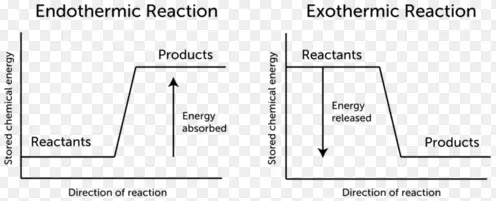
Exotherme Reaktion
- Exotherme Reaktionen sind Reaktionen oder Prozesse, die Energie, meist in Form von Wärme oder Licht, an ihre Umgebung abgeben.
- Bei dieser Reaktionsart wird Energie freigesetzt, da die Gesamtenergie der Produkte geringer ist als die Gesamtenergie der Reaktionspartner.
- Die Enthalpieänderung ist für exotherme Reaktionen ein negativer Wert.
- Die Temperatur steigt mit dem Fortschreiten exothermer Reaktionen.
- Einige Beispiele für exotherme Reaktionen sind Thermitreaktion, Oxidation von Metallen, Lagerfeuer, Explosionen, Kernspaltung, brennende Kohle und Eisherstellungsverfahren.
- Bei exothermen Reaktionen wird Energie aus dem System freigesetzt.
- Die Endprodukte sind in exothermen Reaktionen stabil.
Endotherme Reaktion
- Endotherme Reaktionen sind Reaktionen, die externe Energie, meist in Form von Wärme, benötigen, damit die Reaktion abläuft. Da sie Wärme aus ihrer Umgebung aufnehmen, neigen sie dazu, ihre Umgebung abzukühlen.
- Diese Art von Reaktion ist nicht spontan, weil sie Produkte liefert, die eine höhere Energie als die Reaktanten haben.
- Die Enthalpieänderung ist ein positiver Wert für endotherme Reaktionen.
- Die Temperatur sinkt mit dem Fortschreiten der endothermen Reaktionen.
- Einige Beispiele für endotherme Reaktionen sind Photosynthese, Auflösung von Eis, Dissipation von flüssigem Wasser, Sublimation von Kohlendioxid (Trockeneis),
- Bei einer endothermen Reaktion wird dem System Energie zugeführt.
- Endprodukte der endothermen Reaktion sind weniger stabil.
Unterschiede zwischen exothermer und endothermer Reaktion in Tabellenform
| VERGLEICHSGRUNDLAGE | EXOTHERMISCH | ENDOTHERMISCH |
| Beschreibung | Exotherme Reaktionen sind Reaktionen oder Prozesse, die Energie, meist in Form von Wärme oder Licht, an ihre Umgebung abgeben. | Endotherme Reaktionen sind Reaktionen, die externe Energie, meist in Form von Wärme, benötigen, damit die Reaktion abläuft. Da sie Wärme aus ihrer Umgebung aufnehmen, neigen sie dazu, ihre Umgebung abzukühlen. |
| Produkte | Bei dieser Reaktionsart wird Energie freigesetzt, da die Gesamtenergie der Produkte geringer ist als die Gesamtenergie der Reaktionspartner. | Diese Art von Reaktion ist nicht spontan, weil sie Produkte liefert, die eine höhere Energie als die Reaktanten haben. |
| Änderung der Enthalpie | Die Enthalpieänderung ist für exotherme Reaktionen ein negativer Wert. | Die Enthalpieänderung ist ein positiver Wert für endotherme Reaktionen. |
| Temperatur | Die Temperatur steigt mit dem Fortschreiten exothermer Reaktionen. | Die Temperatur sinkt mit dem Fortschreiten der endothermen Reaktionen. |
| Beispiele | Einige Beispiele für exotherme Reaktionen sind Thermitreaktion, Oxidation von Metallen, Lagerfeuer, Explosionen, Kernspaltung, brennende Kohle und Eisherstellungsverfahren. | Einige Beispiele für endotherme Reaktionen sind die Photosynthese, das Auflösen von Eis, das Dissipieren von flüssigem Wasser, die Sublimation von Kohlendioxid (Trockeneis), |
| Energie | Bei exothermen Reaktionen wird Energie aus dem System freigesetzt. | Bei einer endothermen Reaktion wird dem System Energie zugeführt. |
| Stabilität der Endprodukte | Die Endprodukte sind in exothermen Reaktionen stabil. | Endprodukte der endothermen Reaktion sind weniger stabil. |
Ähnlichkeiten zwischen exothermen und endothermen Reaktionen
- Bei beiden Reaktionen wird eine neue Substanz gebildet.
- An beiden Reaktionen ist Energie beteiligt.
- Bei beiden Reaktionen findet eine chemische Veränderung statt.
- Bei beiden Reaktionen gibt es signifikante Temperaturänderungen.
Zusammenfassung
Exotherme Reaktionen sind Reaktionen oder Prozesse, die Energie, normalerweise in Form von Wärme oder Licht, an ihre Umgebung freisetzen, während endotherme Reaktionen Reaktionen sind, die externe Energie, normalerweise in Form von Wärme, benötigen, damit die Reaktion abläuft.
