Contents
Daniell Cell
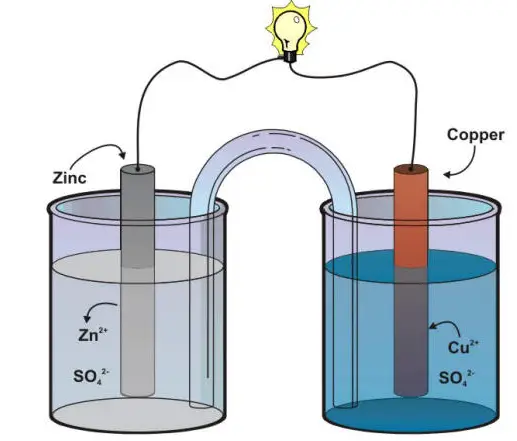
Die Daniell-Zelle ist eine Art elektrochemischer Zelle, die 1836 von John Frederic Daniell, einem britischen Chemiker und Meteorologen, erfunden wurde und aus einem mit einer Kupfer(II)-Sulfatlösung gefüllten Kupfertopf besteht, der in einen unglasierten, mit Schwefelsäure gefüllten Tonbehälter getaucht ist und eine Zinkelektrode. Die Daniell-Zelle kann verwendet werden, um “Strom zu erzeugen” oder Strom zu speichern, indem eine Elektrode verbraucht wird.
Die Redoxreaktion ist die Theorie hinter der Daniell-Zelle. In einer Daniell-Zelle fließen Elektronen durch einen externen Stromkreis von der Zinkelektrode zur Kupferelektrode, während Metallionen durch die Salzbrücke eine Halbzelle zur anderen bilden. In dieser Zelle fließt Strom über einen externen Stromkreis von der Kupferelektrode zur Zinkelektrode, also von der Kathode zur Anode. Dabei dient eine Salzbrücke als elektrischer Kontakt zwischen den beiden Halbzellen. Es verhindert den mechanischen Fluss der Lösung, bietet jedoch einen freien Weg für die Wanderung von Ionen, um einen elektrischen Strom durch die Elektrolytlösung aufrechtzuerhalten. Es verhindert die Akkumulation von Ladungen.
Es ist wichtig anzumerken, dass die Daniell-Zelle eine reversible Zelle ist, da sie aus negativen Ladungen besteht, die durch den äußeren Stromkreis von der Kathode zur Anode wandern, während die positiven Ionen von der Kathode zur Anode über die Lösung. Die Daniell-Zelle kann konventionell wie folgt dargestellt werden:
Zn (s) +Cu 2+ (wässrig) à Zn 2+ (wässrig) +Cu (s)
Was Sie über Daniell Cell wissen müssen
- Daniell-Zelle ist eine Art elektrochemischer Zelle, die aus einer Kupferelektrode und einer Zinkelektrode besteht, die in Kupfer(II)-Sulfat bzw. Zinksulfat eingetaucht sind.
- Die Daniell-Zelle verwendet Kupfersulfat und Zinksulfat als Elektrolyte für die Vervollständigung der elektrochemischen Zelle und die stattfindende Redoxreaktion.
- Daniell Cell verwendet Kupferkathodenelektroden für spontane Redoxreaktionen aufgrund ihrer Fähigkeit, ein ausgezeichnetes Reduktionsmittel zu sein.
- In der Daniell-Zelle besteht die Anodenelektrode aus einer Zinkelektrode als Oxidationsmittel, damit eine Redoxreaktion stattfindet.
Galvanische Zelle
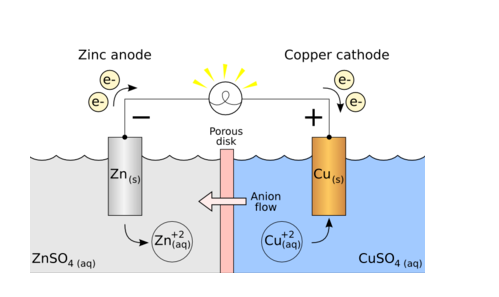
Eine galvanische Zelle, auch Voltaische Zelle genannt, benannt nach Luigi Galvani bzw. Alessandro Volta, ist eine elektrochemische Zelle, die die chemische Energie spontaner Redoxreaktionen in elektrische Energie umwandelt. Es besteht in der Regel aus zwei Halbzellen und einer Salzbrücke. Jede Halbzelle besteht außerdem aus einer in einen Elektrolyten getauchten Metallelektrode. Diese beiden Halbzellen sind mit Hilfe von Metalldrähten extern mit einem Voltmeter und einem Schalter verbunden.
Die Funktionsweise einer galvanischen Zelle ist recht einfach. Dabei handelt es sich um eine chemische Reaktion, die als Endergebnis die elektrische Energie zur Verfügung stellt. Während einer Redoxreaktion nutzt eine galvanische Zelle die Energieübertragung zwischen Elektronen, um chemische in elektrische Energie umzuwandeln.
Wenn in einer galvanischen Zelle eine Elektrode dem Elektrolyten an der Elektroden-Elektrolyt-Grenzfläche ausgesetzt ist, neigen Atome der Metallelektrode dazu, Ionen in der Elektrolytlösung zu erzeugen, die die Elektronen an der Elektrode zurücklassen, wodurch die Metallelektrode negativ wird berechnet. Gleichzeitig neigen Metallionen in der Elektrolytlösung dazu, sich auf einer Metallelektrode abzulagern, wodurch die Elektrode positiv geladen wird. Von den beiden Elektroden wird die Elektrode, an der die Oxidation stattfindet, als Anode bezeichnet, während die Elektrode, an der die Reduktion stattfindet, als Kathode bezeichnet wird.
Was Sie über galvanische Zellen wissen müssen
- Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die eine spontane Redoxreaktion verwendet, um elektrische Energie zu erzeugen.
- In der galvanischen Zelle sind die verwendeten Elektrolyte die Salze der Metalle jeder Elektrode.
- In einer galvanischen Zelle kann die Kathodenelektrode aus jedem Metall bestehen, das reduzieren kann.
- Bei einer galvanischen Zelle besteht die Anode aus einem Metall, das oxidiert werden kann.
Lesen Sie auch: Unterschied zwischen Elektrolytzelle und elektrochemischer Zelle
Unterschied zwischen Daniell-Zelle und galvanischer Zelle in Tabellenform
| VERGLEICHSGRUNDLAGE | DANIELL CELL | GALVANISCHE ZELLE |
| Beschreibung | Daniell-Zelle ist eine Art elektrochemischer Zelle, die aus einer Kupferelektrode und einer Zinkelektrode besteht, die in Kupfer(II)-Sulfat bzw. Zinksulfat eingetaucht sind. | Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die eine spontane Redoxreaktion verwendet, um elektrische Energie zu erzeugen. |
| Elektrolyt | Die Daniell-Zelle verwendet Kupfersulfat und Zinksulfat als Elektrolyte für die Vervollständigung der elektrochemischen Zelle und die stattfindende Redoxreaktion. | Die verwendeten Elektrolyte sind die Salze von Metallen jeder Elektrode. |
| Kathode | Daniell Cell verwendet Kupferkathodenelektroden für spontane Redoxreaktionen aufgrund ihrer Fähigkeit, ein ausgezeichnetes Reduktionsmittel zu sein. | Die Kathodenelektrode kann aus jedem Metall bestehen, das reduzieren kann. |
| Anode | Die Anodenelektrode besteht aus einer Zinkelektrode als Oxidationsmittel, damit eine Redoxreaktion stattfindet. | Die Anode besteht aus einem oxidierbaren Metall. |
Daniell Cell
Die Daniell-Zelle ist eine Art elektrochemischer Zelle, die 1836 von John Frederic Daniell, einem britischen Chemiker und Meteorologen, erfunden wurde und aus einem mit einer Kupfer(II)-Sulfatlösung gefüllten Kupfertopf besteht, der in einen unglasierten, mit Schwefelsäure gefüllten Tonbehälter getaucht ist und eine Zinkelektrode. Die Daniell-Zelle kann verwendet werden, um “Strom zu erzeugen” oder Strom zu speichern, indem eine Elektrode verbraucht wird.
Die Redoxreaktion ist die Theorie hinter der Daniell-Zelle. In einer Daniell-Zelle fließen Elektronen durch einen externen Stromkreis von der Zinkelektrode zur Kupferelektrode, während Metallionen durch die Salzbrücke eine Halbzelle zur anderen bilden. In dieser Zelle fließt Strom über einen externen Stromkreis von der Kupferelektrode zur Zinkelektrode, also von der Kathode zur Anode. Dabei dient eine Salzbrücke als elektrischer Kontakt zwischen den beiden Halbzellen. Es verhindert den mechanischen Fluss der Lösung, bietet jedoch einen freien Weg für die Wanderung von Ionen, um einen elektrischen Strom durch die Elektrolytlösung aufrechtzuerhalten. Es verhindert die Akkumulation von Ladungen.
Es ist wichtig anzumerken, dass die Daniell-Zelle eine reversible Zelle ist, da sie aus negativen Ladungen besteht, die durch den äußeren Stromkreis von der Kathode zur Anode wandern, während die positiven Ionen von der Kathode zur Anode über die Lösung. Die Daniell-Zelle kann konventionell wie folgt dargestellt werden:
Zn (s) +Cu 2+ (wässrig) à Zn 2+ (wässrig) +Cu (s)

Was Sie über Daniell Cell wissen müssen
- Daniell-Zelle ist eine Art elektrochemischer Zelle, die aus einer Kupferelektrode und einer Zinkelektrode besteht, die in Kupfer(II)-Sulfat bzw. Zinksulfat eingetaucht sind.
- Die Daniell-Zelle verwendet Kupfersulfat und Zinksulfat als Elektrolyte für die Vervollständigung der elektrochemischen Zelle und die stattfindende Redoxreaktion.
- Daniell Cell verwendet Kupferkathodenelektroden für spontane Redoxreaktionen aufgrund ihrer Fähigkeit, ein ausgezeichnetes Reduktionsmittel zu sein.
- In der Daniell-Zelle besteht die Anodenelektrode aus einer Zinkelektrode als Oxidationsmittel, damit eine Redoxreaktion stattfindet.
Galvanische Zelle
Eine galvanische Zelle, auch Voltaische Zelle genannt, benannt nach Luigi Galvani bzw. Alessandro Volta, ist eine elektrochemische Zelle, die die chemische Energie spontaner Redoxreaktionen in elektrische Energie umwandelt. Es besteht in der Regel aus zwei Halbzellen und einer Salzbrücke. Jede Halbzelle besteht außerdem aus einer in einen Elektrolyten getauchten Metallelektrode. Diese beiden Halbzellen sind mit Hilfe von Metalldrähten extern mit einem Voltmeter und einem Schalter verbunden.
Die Funktionsweise einer galvanischen Zelle ist recht einfach. Dabei handelt es sich um eine chemische Reaktion, die als Endergebnis die elektrische Energie zur Verfügung stellt. Während einer Redoxreaktion nutzt eine galvanische Zelle die Energieübertragung zwischen Elektronen, um chemische in elektrische Energie umzuwandeln.
Wenn in einer galvanischen Zelle eine Elektrode dem Elektrolyten an der Elektroden-Elektrolyt-Grenzfläche ausgesetzt ist, neigen Atome der Metallelektrode dazu, Ionen in der Elektrolytlösung zu erzeugen, die die Elektronen an der Elektrode zurücklassen, wodurch die Metallelektrode negativ wird berechnet. Gleichzeitig neigen Metallionen in der Elektrolytlösung dazu, sich auf einer Metallelektrode abzulagern, wodurch die Elektrode positiv geladen wird. Von den beiden Elektroden wird die Elektrode, an der die Oxidation stattfindet, als Anode bezeichnet, während die Elektrode, an der die Reduktion stattfindet, als Kathode bezeichnet wird.

Was Sie über galvanische Zellen wissen müssen
- Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die eine spontane Redoxreaktion verwendet, um elektrische Energie zu erzeugen.
- In der galvanischen Zelle sind die verwendeten Elektrolyte die Salze der Metalle jeder Elektrode.
- In einer galvanischen Zelle kann die Kathodenelektrode aus jedem Metall bestehen, das reduzieren kann.
- Bei einer galvanischen Zelle besteht die Anode aus einem Metall, das oxidiert werden kann.
Lesen Sie auch: Unterschied zwischen Elektrolytzelle und elektrochemischer Zelle
Unterschied zwischen Daniell-Zelle und galvanischer Zelle in Tabellenform
| VERGLEICHSGRUNDLAGE | DANIELL CELL | GALVANISCHE ZELLE |
| Beschreibung | Daniell-Zelle ist eine Art elektrochemischer Zelle, die aus einer Kupferelektrode und einer Zinkelektrode besteht, die in Kupfer(II)-Sulfat bzw. Zinksulfat eingetaucht sind. | Eine galvanische Zelle ist eine Art elektrochemischer Zelle, die eine spontane Redoxreaktion verwendet, um elektrische Energie zu erzeugen. |
| Elektrolyt | Die Daniell-Zelle verwendet Kupfersulfat und Zinksulfat als Elektrolyte für die Vervollständigung der elektrochemischen Zelle und die stattfindende Redoxreaktion. | Die verwendeten Elektrolyte sind die Salze von Metallen jeder Elektrode. |
| Kathode | Daniell Cell verwendet Kupferkathodenelektroden für spontane Redoxreaktionen aufgrund ihrer Fähigkeit, ein ausgezeichnetes Reduktionsmittel zu sein. | Die Kathodenelektrode kann aus jedem Metall bestehen, das reduzieren kann. |
| Anode | Die Anodenelektrode besteht aus einer Zinkelektrode als Oxidationsmittel, damit eine Redoxreaktion stattfindet. | Die Anode besteht aus einem oxidierbaren Metall. |
