Manchmal werden galvanische Zellen nur als elektrochemische Zellen bezeichnet, während sie elektrochemische Zellen sind; Elektrolysezellen sind auch elektrochemische Zellen. Elektrolytische und galvanische Zellen sind jedoch nicht dasselbe.
Eine galvanische Zelle ist eine elektrochemische Zelle, die durch eine spontane chemische Reaktion chemische potentielle Energie in elektrische potentielle Energie umwandelt. Eine galvanische Zelle besteht aus zwei Halbzellen, wobei jede Halbzelle eine Elektrode in einem Elektrolyten enthält. Normalerweise ist eine Trennung wichtig, um einen direkten chemischen Kontakt der Oxidations- und Reduktionsreaktionen zu verhindern, wodurch eine Potentialdifferenz entsteht. Die während der Oxidationsreaktion erzeugten Elektronen durchlaufen einen externen Kreislauf, bevor sie von der Reduktionsreaktion verwendet werden.
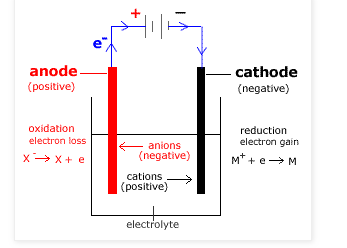
Eine Elektrolysezelle ist eine elektrochemische Zelle, die elektrische potentielle Energie in chemische potentielle Energie umwandelt, indem sie Elektrizität verwendet, um eine nicht-spontane chemische Reaktion anzutreiben. Eine Elektrolysezelle wird normalerweise durch Anlegen eines elektrischen Potentials über die Elektrode aktiviert, um eine interne chemische Reaktion zwischen den Elektroden und Ionen, die sich in der Elektrolytlösung befinden, zu erzwingen. Dieser Vorgang wird als Elektrolyse bezeichnet .
Der Hauptunterschied
- Eine elektrolytische Zelle wandelt elektrische Energie in chemische Energie um, während eine galvanische Zelle chemische Energie in elektrische Energie umwandelt.
- In der Elektrolysezelle ist die Anode positiv und die Kathode ist die negative Elektrode. Die Reaktion an der Anode ist Oxidation und an der Kathode ist Reduktion. Im Gegensatz dazu ist in einer galvanischen Zelle die Anode negativ und die Kathode positiv. Die Reaktion an der Anode ist Oxidation und an der Kathode ist Reduktion.
- In Elektrolysezellen ist die Redoxreaktion nicht spontan und es muss elektrische Energie zugeführt werden, um die Reaktion zu starten. In der galvanischen Zelle hingegen ist die Redoxreaktion spontan und für die Erzeugung elektrischer Energie verantwortlich.
- In der Elektrolysezelle liefert die externe Batterie die Elektronen. Die Elektronen treten durch die Kathode ein und kommen durch die Anode heraus, während in der galvanischen Zelle die Elektronen von oxidierten Spezies geliefert werden. Sie wandern im äußeren Kreislauf von der Anode zur Kathode.
- In einer Elektrolysezelle werden beide Elektroden in denselben Behälter in eine Lösung aus geschmolzenem Elektrolyt eingetaucht. Der Elektrolyt kann eine Schmelze oder eine wässrige Lösung eines Salzes, einer Säure oder eines Alkalis sein. Andererseits sind bei einer galvanischen Zelle die beiden Halbzellen in unterschiedlichen Behältern angeordnet und durch die Salzbrücke oder semipermeable Membran verbunden.
- Elektrolysezellen haben verschiedene Anwendungen wie Galvanisieren, Extrahieren reiner Metalle aus Legierungen, Produktion von Sauerstoff und Wasserstoff für kommerzielle und industrielle Zwecke. Andererseits werden galvanische Zellen üblicherweise als Akkumulatoren oder Batterien bezeichnet und werden meist als elektrische Stromquelle verwendet.
Unterschied zwischen Elektrolytzelle und galvanischer Zelle
| VERGLEICHSGRUNDLAGE | ELEKTROLYTISCHE ZELLE | GALVANISCHE ZELLE |
| Funktion | Eine Elektrolysezelle wandelt elektrische Energie in chemische Energie um. | Eine galvanische Zelle wandelt chemische Energie in elektrische Energie um. |
| Anode & Kathode | Die Anode ist positiv und die Kathode ist die negative Elektrode. Die Reaktion an der Anode ist Oxidation und an der Kathode ist Reduktion. | Die Anode ist negativ und die Kathode ist positiv. Die Reaktion an der Anode ist Oxidation und an der Kathode ist Reduktion. |
| Lieferung von Elektronen | Die externe Batterie liefert die Elektronen. Die Elektronen treten durch die Kathode ein und durch die Anode aus. | Die Elektronen werden von Spezies geliefert, die oxidiert werden. Sie wandern im äußeren Kreislauf von der Anode zur Kathode. |
| Entwurf | Beide Elektroden werden in den gleichen Behälter in Lösung von geschmolzenem Elektrolyt eingetaucht. Der Elektrolyt kann eine Schmelze oder eine wässrige Lösung eines Salzes, einer Säure oder eines Alkalis sein. | Die beiden Halbzellen sind in unterschiedlichen Behältern angeordnet und durch die Salzbrücke oder semipermeable Membran verbunden. |
| Verwendet | Haben verschiedene Anwendungen wie Galvanisieren, Extrahieren reiner Metalle aus Legierungen, Produktion von Sauerstoff und Wasserstoff für kommerzielle und industrielle Zwecke. | Allgemein als Akkumulatoren oder Batterien bezeichnet und werden normalerweise als elektrische Stromquelle verwendet. |
