Contents
Hämoglobin
Hämoglobin ist das Proteinmolekül in den roten Blutkörperchen, das Sauerstoff von der Lunge in das Körpergewebe transportiert und Kohlendioxid aus dem Gewebe zurück in die Lunge zurückführt.
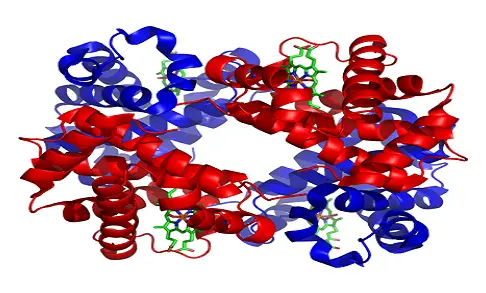
Hämoglobin besteht aus vier miteinander verbundenen Proteinmolekülen (Globulinketten). Das normale Hämoglobin-Molekül (abgekürzt Hgb oder Hb) für Erwachsene enthält zwei Alpha-Globulin-Ketten und zwei Beta-Globulin-Ketten. Bei Föten und Säuglingen sind Betaketten nicht üblich und das Hämoglobinmolekül besteht aus zwei Alphaketten und zwei Gammaketten. Wenn das Kind wächst, werden die Gammaketten nach und nach durch Betaketten ersetzt, wodurch die Hämoglobinstruktur des Erwachsenen gebildet wird.
Jede Globulinkette enthält eine wichtige eisenhaltige Porphyrinverbindung namens Häm. Eingebettet in die Hämverbindung ist ein Eisenatom, das für den Transport von Sauerstoff und Kohlendioxid in unserem Blut unerlässlich ist. Das im Hämoglobin enthaltene Eisen ist auch für die rote Farbe des Blutes verantwortlich.
Hämoglobin spielt auch eine wichtige Rolle bei der Aufrechterhaltung der Form der roten Blutkörperchen. In ihrer natürlichen Form sind rote Blutkörperchen rund mit schmalen Zentren, die einem Donut ohne Loch in der Mitte ähneln. Eine abnormale Hämoglobinstruktur kann daher die Form der roten Blutkörperchen stören und ihre Funktion und den Fluss durch die Blutgefäße behindern.
Der Hämoglobinspiegel variiert von Person zu Person. Männer haben normalerweise höhere Werte als Frauen. Für die Blutspende wird ein Hämoglobin-Grenzwert festgelegt, um sicherzustellen, dass Ihr Hämoglobinwert nach der Blutspende nicht unter den Normalwert sinkt. Die normalen Bereiche für Hämoglobin unterscheiden sich zwischen ethnischen Bevölkerungsgruppen und Männern und Frauen und werden auch vom Alter beeinflusst, insbesondere bei Frauen. Personen mit Hämoglobinwerten unterhalb des Normbereichs sind per Definition anämisch. Es gibt viele Ursachen für Anämie und Anämie aufgrund von Eisenmangel ist weit verbreitet.
Fakten über Hämoglobin
- Hämoglobin ist ein eisen- und sauerstoffbindendes Protein im Blut, insbesondere roten Blutkörperchen.
- Hämoglobin wird als Hb abgekürzt.
- Hämoglobin hat ein Molekulargewicht von 64 kDa.
- Hämoglobin hat 4 Polypeptidketten: Alpha, Beta, Delta und Gamma oder Epsilon (je nach Hämoglobintyp).
- Systematisch am ganzen Körper präsentieren.
- Hämoglobin kommt als tetrameres Protein vor und bindet molekularen Sauerstoff an die roten Blutkörperchen und sorgt so für deren Verteilung im Körper.
- Hämoglobintypen umfassen Hämoglobin A, Hämoglobin A2 und Hämoglobin F.
- Nimmt Sauerstoff aus der Lunge auf und transportiert ihn zum Rest des Körpers.
- Sauerstoffbindung durch PH und CO2 beeinflusst.
- Hämoglobin zeigt eine sigmoide Kurve in Bezug auf die Sauerstoffdissoziation (Sauerstoffbindung an Hämoglobin bei neutralem pH).
- Zeigt eine Quartärstruktur, die für viele globuläre Proteine mit mehreren Untereinheiten charakteristisch ist.
- Hämoglobin hat eine geringe Affinität zur Sauerstoffbindung.
- Beim Menschen kommt Hämoglobin im gesamten Blutkreislauf vor.
Lesen Sie auch: Unterschied zwischen weißen und roten Blutkörperchen
Myoglobin
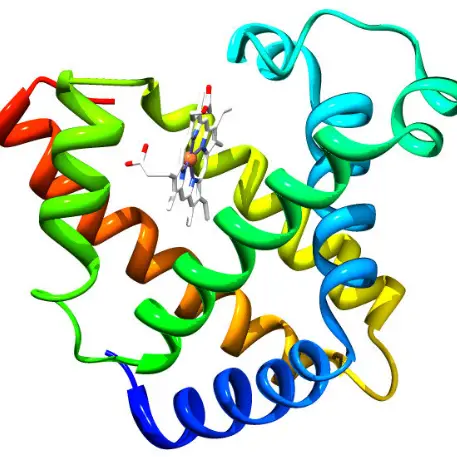
Myoglobin ist ein kleines, monomeres Protein, das als intrazellulärer Sauerstoffspeicher dient. Es kommt reichlich in der Skelettmuskulatur von Wirbeltieren vor und ist für die charakteristische rote Farbe des Muskelgewebes verantwortlich. Es fängt Sauerstoff in den Muskelzellen ein und ermöglicht es den Zellen, die Energie zu produzieren, die für die Muskelkontraktion erforderlich ist.
Hohe Konzentrationen von Myoglobin in Muskelzellen ermöglichen es Organismen, den Atem über einen längeren Zeitraum anzuhalten. Tauchende Säugetiere wie Wale und Robben haben Muskeln mit einem besonders hohen Myoglobinreichtum.
Bei einer Verletzung des Herz- oder Skelettmuskels wird Myoglobin ins Blut freigesetzt. Erhöhte Werte können innerhalb weniger Stunden nach einer Verletzung gemessen werden.
Myoglobin wird von den Nieren aus dem Blut gefiltert und in den Urin abgegeben. Große Mengen an Myoglobin sind giftig für die Nieren. Wenn signifikante Mengen an Myoglobin in den Blutkreislauf freigesetzt werden, was nach schweren Traumata oder Muskelverletzungen passieren kann, kann das überschüssige Myoglobin die Nieren schädigen und schließlich zu Nierenversagen führen. Die Messung von Myoglobin im Urin hilft, diesen Zustand zu erkennen.
Es besteht eine große chemische Ähnlichkeit zwischen Myoglobin und Hämoglobin, dem sauerstoffbindenden Protein der roten Blutkörperchen. Beide Proteine enthalten einen molekularen Bestandteil namens Häm, der es ihnen ermöglicht, sich reversibel mit Sauerstoff zu verbinden. Die eisenhaltige Hämgruppe verleiht den Proteinen eine rotbraune Farbe. Die Bindung zwischen Sauerstoff und Hämoglobin ist komplexer als die zwischen Sauerstoff und Myoglobin und erklärt die doppelte Fähigkeit des Hämoglobins, Sauerstoff sowohl zu transportieren als auch zu speichern.
Bei Kontakt mit venösem Blut verbindet sich Sauerstoff leichter mit Myoglobin als mit Hämoglobin, wodurch die Übertragung von Sauerstoff aus dem Blut in die Muskelzellen begünstigt wird. Somit wird der Sauerstoff bereitgestellt, den der arbeitende Muskel für die energieerzeugenden biochemischen Reaktionen benötigt.
Fakten über Myoglobin
- Myoglobin ist ein eisen- und sauerstoffbindendes Protein, das im Muskelgewebe von Wirbeltieren im Allgemeinen und in fast allen Säugetieren vorkommt.
- Myoglobin wird als mb . abgekürzt
- Myoglobin hat ein Molekulargewicht von 16,7 kDa
- Myoglobin hat eine einzelne Polypeptidkette.
- Nur im Herzen und in den Muskeln vorhanden.
- Myoglobin kommt als monomeres Protein vor und bindet molekularen Sauerstoff und verteilt ihn an die Muskulatur.
- In allen Zellen findet sich ein einziger Myoglobintyp.
- Speichert Sauerstoff in den Muskelzellen und gibt ihn bei Bedarf wieder ab.
- Die Sauerstoffbindung im Myoglobin wird durch CO2 und PH nicht beeinflusst.
- Myoglobin weist hinsichtlich der Sauerstoffdissoziation eine hyperbolische Kurve auf.
- Zeigt Tertiärstruktur.
- Hat eine hohe Affinität zur Sauerstoffbindung, die nicht von der Sauerstoffkonzentration abhängt.
- Beim Menschen wird Myoglobin nach Muskelverletzungen im Blutkreislauf gefunden.
Lesen Sie auch: Myoglobin vs. Hämoglobin-Sauerstoff-Dissoziationskurve
Unterschiede zwischen Hämoglobin und Myoglobin in Tabellenform
| VERGLEICHSGRUNDLAGE | HÄMOGLOBIN | MYOGLOBINE |
| Definition | Hämoglobin ist ein rotes Protein, das für den Sauerstofftransport im Blut von Wirbeltieren verantwortlich ist. | Myoglobin ist ein rotes Protein mit Häm, das Sauerstoff in Muskelzellen transportiert und speichert. |
| Molekulargewicht | Molekulargewicht beträgt 64 kDa | Molekulargewicht beträgt 16,7 kDa |
| Anzahl der Ketten | Hämoglobin hat 4 Polypeptidketten: Alpha, Beta, Delta und Gamma oder Epsilon (je nach Hämoglobintyp). | Myoglobin hat eine einzelne Polypeptidkette. |
| Standort | Systematisch am ganzen Körper präsentieren. | Nur im Herzen und in den Muskeln vorhanden. |
| Auch bekannt als | Hb | MB |
| Auftreten | Hämoglobin kommt als tetrameres Protein vor. | Myoglobin kommt als monomeres Protein vor. |
| Typen | Hämoglobintypen umfassen Hämoglobin A, Hämoglobin A2 und Hämoglobin F. | In allen Zellen findet sich ein einziger Myoglobintyp. |
| Rollen | Nimmt Sauerstoff aus der Lunge auf und transportiert ihn zum Rest des Körpers. | Speichert Sauerstoff in den Muskelzellen und gibt ihn bei Bedarf wieder ab. |
| Sauerstoffbindung | Sauerstoffbindung durch PH und CO2 beeinflusst. | Sauerstoffbindung wird durch CO2 und PH nicht beeinflusst. |
| Kurven | Hämoglobin weist hinsichtlich der Sauerstoffdissoziation eine sigmoidale Kurve auf. | Myoglobin weist hinsichtlich der Sauerstoffdissoziation eine hyperbolische Kurve auf. |
| Strukturebene | Zeigt Quartärstruktur. | Zeigt Tertiärstruktur. |
| Bindungsaffinität | Hämoglobin hat eine geringe Affinität zur Sauerstoffbindung. | Hat eine hohe Affinität zur Sauerstoffbindung, die nicht von der Sauerstoffkonzentration abhängt. |
Lesen Sie auch: Unterschied zwischen Lymphe und Blut
Ähnlichkeiten zwischen Hämoglobin und Myoglobin
- Sowohl Myoglobin als auch Hämoglobin verleihen dem Blut und den Muskeln eine rote Farbe.
- Beide enthalten sauerstoffbindende Häm
- Beides sind globuläre Proteine.
