Contents
Was ist eine kovalente Bindung?
Eine kovalente Bindung, auch als molekulare Bindung bezeichnet, ist eine chemische Bindung, die die gemeinsame Nutzung von Elektronenpaaren zwischen Atomen beinhaltet. Diese Elektronenpaare werden als geteilte Paare oder Bindungspaare bezeichnet, und das stabile Gleichgewicht der anziehenden und abstoßenden Kräfte zwischen Atomen, wenn sie Elektronen teilen, wird als kovalente Bindung bezeichnet.
Kovalente Bindungen treten meist zwischen Nichtmetallen oder zwischen zwei gleichen (oder ähnlichen) Elementen auf. Zwei Atome mit ähnlicher Elektronegativität tauschen kein Elektron aus ihrer äußersten Schale aus; die Atome teilen sich stattdessen Elektronen, so dass ihre Valenzelektronenschale gefüllt ist.
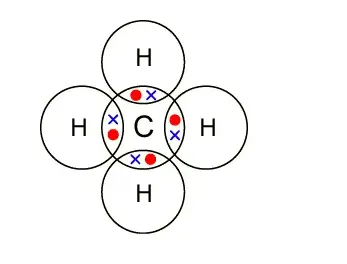
In der organischen Chemie sind kovalente Bindungen viel häufiger als ionische Bindungen. Eine kovalente Bindung bildet sich, wenn die gebundenen Atome eine niedrigere Gesamtenergie haben als weit voneinander entfernte Atome. Bei vielen Molekülen ermöglicht die gemeinsame Elektronenverteilung jedem Atom, das Äquivalent einer vollständigen äußeren Hülle zu erreichen, was einer stabilen elektronischen Konfiguration entspricht.
Ein gutes Beispiel dafür, wo eine kovalente Bindung gefunden wird, ist zwischen dem Sauerstoff und jedem Wasserstoff in einem Wassermolekül (H 2 O). Jede der kovalenten Bindungen enthält zwei Elektronen, eines von einem Wasserstoffatom und eines vom Sauerstoffatom. Beide Atome teilen sich die Elektronen.
Beispiele für Verbindungen, die kovalente Bindungen enthalten, umfassen:
- Methan (CH4)
- Kohlenmonoxid (CO)
- Jodmonobromid (IBr)
- Ammoniak (NH 3 )
- Wasserstoff (H 2 )
- Stickstoff (N 2 )
Durch die gemeinsame Nutzung von Elektronen weisen kovalente Verbindungen charakteristische physikalische Eigenschaften auf, die im Vergleich zu ionischen Verbindungen niedrigere Schmelzpunkte und eine niedrigere elektrische Leitfähigkeit umfassen.
Was Sie über kovalente Bindungen wissen müssen
- Elektronen in einer kovalenten Bindung werden zu gleichen Teilen zwischen den Atomen aufgeteilt.
- Kovalente Bindungen bilden sich zwischen zwei Nichtmetallen.
- Moleküle, die durch kovalente Bindungen gebildet werden, haben einen niedrigen Schmelzpunkt.
- Moleküle, die durch kovalente Bindungen gebildet werden, haben einen niedrigen Siedepunkt.
- Bei Raumtemperatur und normalem Atmosphärendruck sind kovalent gebundene Moleküle entweder Flüssigkeiten oder Gase.
- Kovalente Bindungen sind leichter zu brechen.
- Die Reaktionskomponenten kovalenter Bindungen sind elektrisch neutral.
- Kovalente Bindungsverbindungen sind in Wasser und anderen polaren Lösungsmitteln unlöslich.
- Kovalente Bindungsverbindungen sind schlechte Leiter.
- Molekulare Reaktionen kovalent gebundener Atome verlaufen vergleichsweise langsam.
- Elektronenorbitale in kovalenten Bindungen überlappen.
Was sind ionische Bindungen?
Ionenbindung tritt auf, wenn zwischen zwei Atomen ein großer Unterschied in der Elektronegativität besteht. Dieser große Unterschied führt zum Verlust eines Elektrons des weniger elektronegativen Atoms und zum Gewinn dieses Elektrons durch das elektronegativere Atom, was zu zwei Ionen führt. Diese entgegengesetzt geladenen Ionen fühlen sich gegenseitig angezogen und diese elektrostatische Anziehung bildet eine Ionenbindung.
Einfacher ausgedrückt entsteht eine Ionenbindung durch die Übertragung von Elektronen von einem Metall auf ein Nichtmetall, um eine vollständige Valenzschale für beide Atome zu erhalten, dh die Bildung von Natriumchlorid. Wenn Natrium ( Na ) und Chlor ( Cl ) kombiniert werden, verlieren die Natriumatome ein Elektron und bilden Kationen (Na + ) und die Chloratome nehmen jeweils ein Elektron auf, um Anionen ( Cl – ) zu bilden. Diese Ionen werden dann im gleichen Verhältnis (Verhältnis 1:1) zueinander angezogen, um Natriumchlorid ( NaCl ) zu bilden.
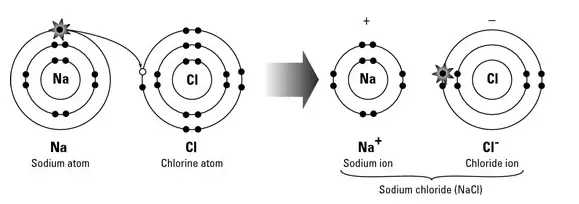
Bei ionischen Bindungen verliert das Metall Elektronen, um ein positiv geladenes Kation zu werden, während das Nichtmetall diese Elektronen aufnimmt, um ein negativ geladenes Anion zu werden. Dieser Elektronentransfer wird als Elektrovalenz bezeichnet.
Ionische Verbindungen leiten Elektrizität im wässrigen oder geschmolzenen Zustand und nicht im festen Zustand. Je nach Ladung haben ionische Verbindungen einen hohen Schmelzpunkt. Je höher die Ladung, desto stärker die Kohäsionskräfte und desto höher der Schmelzpunkt. Noch wichtiger ist, dass sie dazu neigen, in Wasser löslich zu sein, je stärker die Kohäsionskräfte, desto geringer die Löslichkeit.
Beispiel für ionische Bindungen und Verbindungen
- Natriumbromid (NaBr)
- Magnesiumoxid (MgO)
- Natriumfluorid (NaF)
- Calciumchlorid (CaCl 2 )
- Kaliumjodid (KI)
- Kaliumbromid (KBr)
- Kaliumchlorid (KCl)
- Kaliumoxid (K 2 O)
Was Sie über Ionenbindungen wissen müssen
- Eine Ionenbindung spendet im Wesentlichen ein Elektron an das andere an der Bindung beteiligte Atom.
- Ionenbindungen bilden sich zwischen einem Metall und einem Nichtmetall.
- Moleküle, die durch ionische Bindungen gebildet werden, haben einen hohen Schmelzpunkt.
- Moleküle, die durch ionische Bindungen gebildet werden, haben einen hohen Siedepunkt.
- Bei Raumtemperatur und normalem Atmosphärendruck sind ionische Verbindungen Feststoffe.
- Ionenbindungen sind schwer zu brechen.
- Die Reaktionskomponenten ionischer Bindungen sind elektrisch geladen.
- Ionische Bindungsverbindungen sind in Wasser und anderen polaren Lösungsmitteln löslich.
- Ionische Bindungsverbindungen sind im festen Zustand nur schlechte Leiter, aber im geschmolzenen Zustand oder in Lösungsform sind sie gute Leiter.
- Die Reaktion von ionisch gebundenen Atomen ist vergleichsweise schneller.
- Elektronenorbitale in Ionenbindungen sind getrennt.
Lesen Sie auch: Unterschied zwischen kovalenten und Wasserstoffbrücken
Unterschied zwischen ionischen und kovalenten Bindungen in Tabellenform
| VERGLEICHSGRUNDLAGE | KOVALENTE BINDUNG | IONENVERBINDUNG |
| Elektronen | Elektronen in einer kovalenten Bindung werden zu gleichen Teilen zwischen den Atomen aufgeteilt. | Eine Ionenbindung spendet im Wesentlichen ein Elektron an das andere an der Bindung beteiligte Atom. |
| Auftreten | Kovalente Bindungen bilden sich zwischen zwei Nichtmetallen. | Ionenbindungen bilden sich zwischen einem Metall und einem Nichtmetall. |
| Schmelzpunkt | Moleküle, die durch kovalente Bindungen gebildet werden, haben einen niedrigen Schmelzpunkt. | Moleküle, die durch ionische Bindungen gebildet werden, haben einen hohen Schmelzpunkt. |
| Siedepunkt | Moleküle, die durch kovalente Bindungen gebildet werden, haben einen niedrigen Siedepunkt. | Moleküle, die durch ionische Bindungen gebildet werden, haben einen hohen Siedepunkt. |
| Staat bei STP | Bei Raumtemperatur und normalem Atmosphärendruck sind kovalent gebundene Moleküle entweder Flüssigkeiten oder Gase. | Bei Raumtemperatur und normalem Atmosphärendruck sind ionische Verbindungen Feststoffe. |
| Bruch | Kovalente Bindungen sind leichter zu brechen. | Ionenbindungen sind schwer zu brechen. |
| Elektrische Ladung | Die Reaktionskomponenten kovalenter Bindungen sind elektrisch neutral. | Die Reaktionskomponenten ionischer Bindungen sind elektrisch geladen. |
| Löslichkeit | Kovalente Bindungsverbindungen sind in Wasser und anderen polaren Lösungsmitteln unlöslich. | Ionische Bindungsverbindungen sind in Wasser und anderen polaren Lösungsmitteln löslich. |
| Elektrische Leitfähigkeit | Kovalente Bindungsverbindungen sind schlechte Leiter. | Ionische Bindungsverbindungen sind im festen Zustand nur schlechte Leiter, aber im geschmolzenen Zustand oder in Lösungsform sind sie gute Leiter. |
| Reaktivität | Molekulare Reaktionen kovalent gebundener Atome verlaufen vergleichsweise langsam. | Die Reaktion von ionisch gebundenen Atomen ist vergleichsweise schneller. |
| Elektronenorbital | Elektronenorbitale in kovalenten Bindungen überlappen. | Elektronenorbitale in Ionenbindungen sind getrennt. |
Ähnlichkeiten zwischen kovalenten und ionischen Bindungen
- Beides sind primäre Bindungen.
- Valenzelektronen sind an beiden Bindungsprozessen beteiligt.
- Beide Bindungsarten führen zur Bildung stabiler chemischer Verbindungen
- Die Bildung kovalenter und ionischer Bindungen ist exotherm
- Verbindungen mit sowohl kovalenten als auch ionischen Verbindungen sind nicht formbar.
- Beide Bindungen führen zur Bildung komplexer Strukturen
- Beides sind starke Bindungen.
