Moyoglobin ist ein eisen- und sauerstoffbindendes Protein, das im Muskelgewebe von Wirbeltieren im Allgemeinen und in fast allen Säugetieren vorkommt. Myoglobin hat eine sehr hohe Affinität zu Sauerstoff und wirkt als Sauerstoffmolekül. Es gibt erst dann Sauerstoff ab, wenn der Sauerstoffpartialdruck drastisch gesunken ist.
Hämoglobin hingegen ist das Proteinmolekül in den roten Blutkörperchen, das Sauerstoff von der Lunge in das Körpergewebe transportiert und Kohlendioxid aus dem Gewebe in die Lunge zurückführt. Die Sauerstoffdissoziationskurve für Hämoglobin hat aufgrund der kooperativen Bindung von Sauerstoff an die 4 Polypeptidketten eine sigmoide Form . Andererseits besteht Myoglobin aus einem einzigen Polypeptid mit nur einer Hämgruppe und ist daher nicht in der Lage, kooperativ zu binden. Folglich ist die Sauerstoffdissoziationskurve für Myoglobin nicht sigmoidal, sondern hyperbolisch. In diesem Artikel finden Sie eine ausführliche Erklärung, wie die beiden Kurven entstehen.
Contents
Hämoglobin-Sauerstoff-Dissoziationskurve
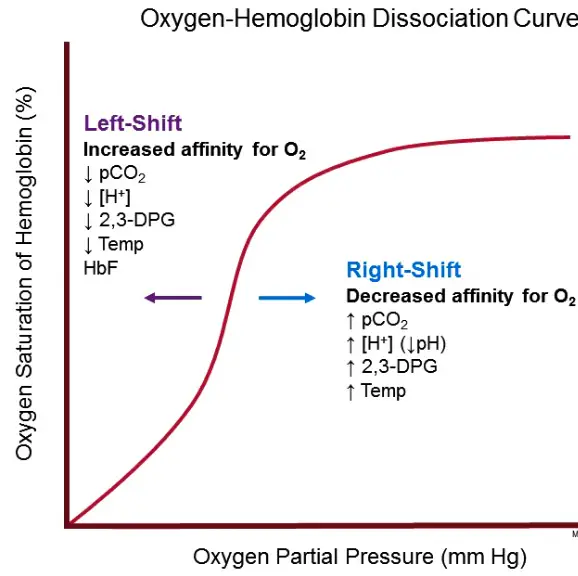
Hämoglobindissoziationskurve auch bekannt als Oxyhämoglobin Dissoziations – Kurve ist eine graphische Darstellung, die Plots der Anteil von Hämoglobin in seiner gesättigten (Sauerstoff beladene) Form auf der vertikalen Achse (Y-Achse) gegen die herrschende Sauerstoffspannung (Partialdruck von Sauerstoff im Blut) auf der horizontalen Achse (x-Achse). Diese Grafik ist ein sehr nützliches Werkzeug, um zu verstehen, wie unser Blut Sauerstoff transportiert und freisetzt.
In roten Blutkörperchen weist die Sauerstoffbindungskurve für Hämoglobin eine ”S”-Form auf, die als sigmoidale Kurve bekannt ist . Eine sigmoidale Kurve zeigt, dass die Sauerstoffbindung kooperativ ist. Kooperative Bindung bedeutet, dass Hämoglobin eine größere Fähigkeit hat, Sauerstoff zu binden, nachdem eine Untereinheit bereits Sauerstoff gebunden hat. Hämoglobin wird daher am stärksten von Sauerstoff angezogen, wenn 3 der 4 Polypeptidketten an Sauerstoff gebunden sind.
Die Interpretation der Affinität des Hämoglobins für Sauerstoff nimmt mit der Bindung aufeinanderfolgender Sauerstoffmoleküle zu. Mit steigendem Sauerstoffpartialdruck binden mehr Moleküle, bis die maximal bindefähige Menge erreicht ist. Bei Annäherung an diese Grenze tritt sehr wenig zusätzliche Bindung auf und die Kurve flacht ab, wenn das Hämoglobin mit Sauerstoff gesättigt wird. Daher hat die Kurve eine sigmoidale oder S-Form.
Bei Drücken über 62 mmHg ist die Standarddissoziationskurve relativ flach, was bedeutet, dass sich der Sauerstoffgehalt des Blutes auch bei starkem Anstieg des Sauerstoffpartialdrucks nicht signifikant ändert. Damit Gewebe mehr Sauerstoff erhalten, wäre eine Bluttransfusion erforderlich, um die Sauerstofftransportkapazität (Hämoglobinzahl) zu erhöhen, oder zusätzlichen Sauerstoff, der den im Plasma gelösten Sauerstoff erhöhen würde. Obwohl die Bindung von Sauerstoff an Hämoglobin bei Drücken von etwa 50 mmHg bis zu einem gewissen Grad anhält, wird der Sauerstoff mit abnehmender Sauerstoffpartialdrücke in diesem steilen Bereich der Kurve leicht an das periphere Gewebe abgegeben, wenn die Affinität des Hämoglobins abnimmt.
Myoglobin-Sauerstoff-Dissoziationskurve
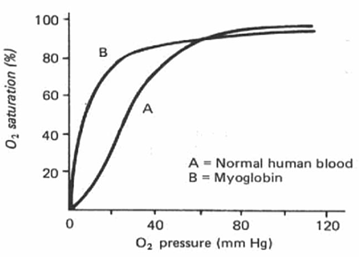
Myoglobin ist ein sauerstoffbindendes Molekül, das im Skelettmuskelgewebe vorkommt. Myoglobin besteht aus einem einzigen Polypeptid mit nur einer Hämgruppe und ist daher nicht in der Lage, kooperativ zu binden. Folglich ist die Sauerstoffdissoziationskurve für Myoglobin nicht sigmoidal, sondern hyperbolisch.
Myoglobin hat eine höhere Affinität zu Sauerstoff als erwachsenes Hämoglobin und wird bei niedrigeren Sauerstoffwerten gesättigt. Myoglobin wird seine Sauerstoffversorgung im Muskel sehr niedrig halten (zum Beispiel bei intensiver körperlicher Aktivität). Die verzögerte Sauerstoffabgabe trägt dazu bei, das Einsetzen der anaeroben Atmung und die Milchsäurebildung während des Trainings zu verlangsamen.
Welche Faktoren beeinflussen die Standard-Sauerstoff-Dissoziationskurve?
Die Sauerstoffdissoziationskurve von Hämoglobin wird seit vielen Jahren umfassend untersucht und mathematisch beschrieben. Es gibt mehrere Faktoren, die immer die Stärke beeinflussen, mit der Sauerstoff an Hämoglobin bindet. Diese Faktoren können die Kurve nach rechts oder links verschieben. Eine Verschiebung nach rechts zeigt an, dass das untersuchte Hämoglobin eine verringerte Affinität für Sauerstoff hat, während eine Verschiebung nach links anzeigt, dass das untersuchte Hämoglobin eine erhöhte Affinität für Sauerstoff hat. Zu diesen Faktoren gehören:
Temperatur
Eine Temperaturabnahme verschiebt die Kurve nach links, während eine Temperaturerhöhung die Kurve nach rechts verschiebt. Wenn die Temperatur steigt, wird die Bindung zwischen Sauerstoff und Hämoglobin denaturiert und dies erhöht die Menge an Sauerstoff und Hämoglobin und verringert die Konzentration von Oxyhämoglobin. Der Temperatureinfluss ist normalerweise schwer wahrzunehmen, aber bei Unter- oder Hyperthermie sind die Auswirkungen deutlich wahrnehmbar.
Organische Phosphate
2,3-Diphospoglycerat (2,3-DPG) ist das wichtigste primäre organische Phosphat. Eine Zunahme von 2,3-DPG verschiebt die Kurve nach rechts, während eine Abnahme von 2,3-DPG die Kurve nach links verschiebt. 2, 3-DPG bindet an Hämoglobin und ordnet es in den T-Zustand um, was seine Affinität für Sauerstoff verringert.
PH
Ein Anstieg des PH verschiebt die Kurve nach links, während ein Abfall des PH die Kurve nach rechts verschiebt. Dies geschieht, weil eine höhere Wasserstoffionenkonzentration eine Veränderung der Aminosäurereste bewirkt, die Desoxyhämoglobin in einem Zustand stabilisiert, der als (der T-Zustand) bekannt ist und eine geringere Affinität für Sauerstoff hat. Diese Verschiebung nach rechts ist als Bohr- Effekt bekannt .
Kohlendioxid (CO2)
Ein Anstieg des CO2 verschiebt die Kurve nach rechts, während ein Abfall des CO2 die Kurve nach links verschiebt. Hämoglobin bindet sich leichter an CO2 als Sauerstoff. Die Ansammlung von CO2 führt zur Bildung von Carbaminoverbindungen , die sich dann an Sauerstoff binden, um Carbaminohämoglobin zu bilden, das dann Desoxyhämoglobin im T-Zustand stabilisiert . Außerdem verursacht die Ansammlung von CO2 eine Zunahme der Wasserstoffionenkonzentration und eine Abnahme des pH-Werts und verschiebt folglich die Kurve nach rechts.
Faktoren, die die Sauerstoffdissoziationskurve in Tabellenform beeinflussen
| FAKTOREN | ZUNAHME | VERRINGERN |
| PH | Linksverschiebung | Rechte Shifttaste |
| CO2 | Rechte Shifttaste | Linksverschiebung |
| Temperatur | Rechte Shifttaste | Linksverschiebung |
| 2,3-DPG | Rechte Shifttaste | Linksverschiebung |
Zusammenfassung
Was ist der Hauptunterschied zwischen Hämoglobin- und Myoglobin-Sauerstoffdissoziationskurve?
Die Hämoglobin-Sauerstoff-Dissoziationskurve hat eine sigmoidale Form, während die Myoglobin-Sauerstoff-Dissoziationskurve eine hyperbolische Form hat.
