Contents
Was sind Isotope?
Isotope sind zwei oder mehr Arten von Atomen, die die gleiche Ordnungszahl (Anzahl der Protonen in ihren Kernen) und Position im Periodensystem haben (und daher zum selben chemischen Element gehören) und die sich aufgrund der Nukleonenzahlen (Massenzahlen) unterscheiden zu unterschiedlich vielen Neutronen in ihren Kernen. Während alle Isotope eines bestimmten Elements fast die gleichen chemischen Eigenschaften haben, haben sie unterschiedliche Atommassen und physikalische Eigenschaften.
Die Anzahl der Protonen im Atomkern wird Ordnungszahl genannt und entspricht der Anzahl der Elektronen im neutralen (nicht ionisierten) Atom. Jede Ordnungszahl identifiziert ein bestimmtes Element, aber nicht das Isotop; ein Atom eines gegebenen Elements kann einen weiten Bereich in seiner Neutronenzahl haben. Die Anzahl der Nukleonen (sowohl Protonen als auch Neutronen) im Kern ist die Massenzahl des Atoms, und jedes Isotop eines bestimmten Elements hat eine andere Massenzahl.
Beispielsweise Kohlenstoff-12, Kohlenstoff-13 und Kohlenstoff-14 sind drei Isotope des Elements Kohlenstoff mit der Massenzahl 12, 13 und 14, jeweils. Die Ordnungszahl von Kohlenstoff ist 6 , was bedeutet, dass jedes Kohlenstoffatom 6 Protonen hat, so dass die Neutronenzahlen dieser Isotope 6, 7 bzw. 8 betragen.
Was Sie über Isotope wissen müssen
- Isotope sind Atome mit einer unterschiedlichen Anzahl von Neutronen, aber sie haben die gleiche Anzahl von Protonen und Elektronen.
- Sie sind Atome desselben Elements.
- Isotope haben die gleiche Ordnungszahl.
- Isotope haben unterschiedliche Atommassen.
- Isotope haben unterschiedliche Neutronenzahlen.
- Isotope eines Elements haben aufgrund der Ähnlichkeit in Anordnung und Anzahl der Elektronen die gleichen chemischen Eigenschaften.
- Isotope nehmen im Periodensystem dieselbe Position ein.
Was sind Isobaren?
Isobaren sind Atome (Nuklide) verschiedener chemischer Elemente mit der gleichen Anzahl von Nukleonen. Dementsprechend unterscheiden sich Isobaren in der Ordnungszahl (oder Anzahl der Protonen), haben aber die gleiche Massenzahl. Ein Beispiel für eine Reihe von Isobaren wäre Argon, Kalium und Calcium mit Atomen der gleichen Massenzahl 40, dh 18 Ar 40 , 19 K 40 und 20 Ca 40 . Während die Kerne dieser Nuklide alle 40 Nukleonen enthalten, enthalten sie eine unterschiedliche Anzahl von Protonen und Neutronen.
18 Ar 40 , 19 K 40 , 20 Ca 40 wobei 18, 19 und 20 als Indizes gezeigt die Ordnungszahlen der drei Elemente sind bzw. Isobaren sind. Da die Ordnungszahlen unterschiedlich sind, sind auch ihre chemischen Eigenschaften unterschiedlich. Die Struktur von Argon, Kalium und Calcium ist unten angegeben.
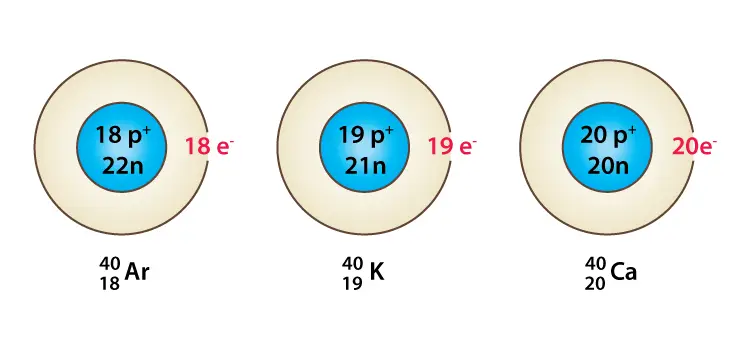
Was Sie über Isobaren wissen müssen
- Isobaren sind Atome verschiedener chemischer Elemente mit gleicher Masse, aber unterschiedlicher Anzahl von Protonen und Elektronen.
- Sie sind Atome verschiedener Elemente.
- Isobaren haben unterschiedliche Ordnungszahlen.
- Isobaren haben die gleiche Atommasse.
- Isobaren haben unterschiedliche Neutronenzahlen.
- Isobaren unterscheiden sich in ihren chemischen Eigenschaften aufgrund der unterschiedlichen Anordnung der Elektronen.
- Isobaren nehmen im Periodensystem unterschiedliche Positionen ein.
Lesen Sie auch : Unterschied zwischen Atomen und Molekülen
Unterschied zwischen Isotopen und Isobaren in Tabellenform
| VERGLEICHSGRUNDLAGE | ISOTOPE | ISOBARS |
| Beschreibung | Isotope sind Atome mit einer unterschiedlichen Anzahl von Neutronen, aber sie haben die gleiche Anzahl von Protonen und Elektronen. | Isobaren sind Atome verschiedener chemischer Elemente mit gleicher Masse, aber unterschiedlicher Anzahl von Protonen und Elektronen. |
| Natur | Sie sind Atome desselben Elements. | Sie sind Atome verschiedener Elemente. |
| Ordnungszahl | Isotope haben die gleiche Ordnungszahl. | Isobaren haben unterschiedliche Ordnungszahlen. |
| Atommasse | Isotope haben unterschiedliche Atommassen. | Isobaren haben die gleiche Atommasse. |
| Anzahl Neutronen | Isotope haben unterschiedliche Neutronenzahlen. | Isobaren haben unterschiedliche Neutronenzahlen. |
| Chemische Eigenschaften | Isotope eines Elements haben aufgrund der Ähnlichkeit in Anordnung und Anzahl der Elektronen die gleichen chemischen Eigenschaften. | Isobaren unterscheiden sich in ihren chemischen Eigenschaften aufgrund der unterschiedlichen Anordnung der Elektronen. |
| Position im Periodensystem | Isotope nehmen im Periodensystem dieselbe Position ein. | Isobaren nehmen im Periodensystem unterschiedliche Positionen ein. |
