Beschreibung
Ein antibindendes Molekülorbital in der Theorie der chemischen Bindung ist eine Art von Molekülorbital (MO), das die chemische Bindung zwischen zwei Atomen schwächt und dazu beiträgt, die Energie des Moleküls relativ zu getrennten Atomen zu erhöhen. Ein solches Orbital weist einen oder mehrere Knoten im Bindungsbereich zwischen den Kernen auf. Die Dichte der Elektronen im Orbital ist außerhalb des Bindungsbereichs konzentriert und bewirkt, dass ein Kern vom anderen weggezogen wird und neigt dazu, eine gegenseitige Abstoßung zwischen den beiden Atomen zu verursachen.
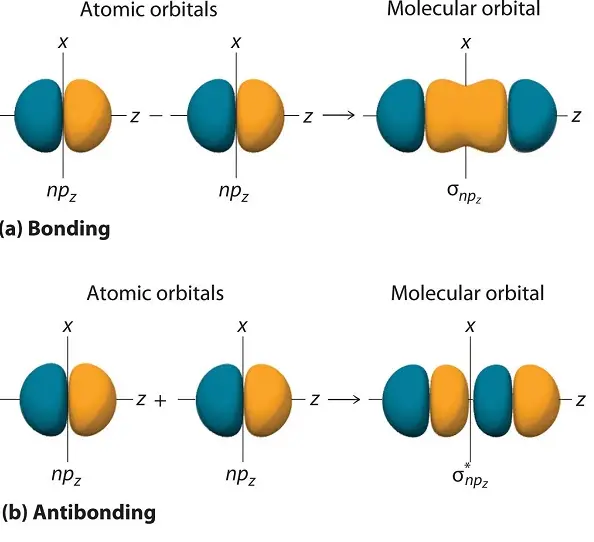
Ein Molekülorbital wird antibindend, wenn die Elektronendichte zwischen den beiden Kernen geringer ist, als wenn es überhaupt keine bindenden Wechselwirkungen gäbe. Wenn ein Molekülorbital an einer Knotenebene zwischen zwei Atomen das Vorzeichen von positiv zu negativ ändert, wird es in Bezug auf diese Atome als antibindend bezeichnet. In Molekülorbitaldiagrammen sind antibindende Orbitale oft mit einem Sternchen (*) gekennzeichnet.
Bindungsmolekülorbitale in der chemischen Bindungstheorie können als anziehende Wechselwirkung zwischen den Atomorbitalen von zwei oder mehr Atomen in einem Molekül beschrieben werden. In dieser Theorie werden Elektronen dazu gebracht, sich in Wellen zu bewegen. Wenn sich mehr als eine dieser Wellen nähert, erzeugt die phasengleiche Kombination dieser Wellen eine Wechselwirkung, die zu einer stark stabilisierten Spezies führt. Das Ergebnis der konstruktiven Interferenz der Wellen führt dazu, dass sich die Dichte der Elektronen innerhalb der Bindungsregion befindet, wodurch eine stabile Bindung zwischen den beiden Spezies entsteht.
Der Unterschied
- Antibindende Molekülorbitale können als Orbitale beschrieben werden, die Elektronen außerhalb des Bereichs zwischen zwei Atomkernen enthalten. Im Gegensatz dazu können bindende Molekülorbitale als eine Art von Molekülorbitalen beschrieben werden, die an der Bildung einer chemischen Bindung beteiligt sind.
- Antibindende Molekülorbitale werden durch phasenverschobene Kombination von Atomorbitalen gebildet. Die Kombination verringert die Elektronendichte im Bereich zwischen den Kernen der Atome und erhöht sich im Bereich abseits des Zwischenkernbereichs. Andererseits werden bindende Molekülorbitale durch phasengleiche Kombination von Atomorbitalen gebildet. Die Kombination erhöht die Elektronendichte im Bereich zwischen den Kernen gebundener Atome.
- Antibindende Molekülorbitale tragen nicht zur Form des Moleküls bei, wohingegen bindende Molekülorbitale direkt zur Form des Moleküls beitragen.
- Antibindende Molekülorbitale werden gebildet, wenn die Lappen der kombinierenden Orbitale ein entgegengesetztes Vorzeichen haben, während bindende Orbitale gebildet werden, wenn die Lappen der kombinierenden Orbitale das gleiche Vorzeichen haben.
- Die Elektronendichte in antibindenden Molekülorbitalen ist gering, während die Elektronendichte in bindenden Molekülorbitalen höher ist.
- Die Energie antibindender Molekülorbitale ist vergleichsweise höher als die Energie bindender Molekülorbitale.
- Antibindende Molekülorbitale werden durch den subtraktiven Effekt der Atomorbitale gebildet, während die bindenden Molekülorbitale durch den additiven Effekt von Atomorbitalen gebildet werden.
- Antibindende Molekülorbitale sind weniger stabil als sowohl bindende Molekülorbitale als auch Elternatomorbitale. Andererseits sind bindende Molekülorbitale stabiler als sowohl antibindende Molekülorbitale als auch Stammatomorbitale.
- Die Elektronen in antibindenden Molekülorbitalen tragen nicht zur Bindungsbildung bei, während die Elektronen in bindenden Molekülorbitalen zur Bindungsbildung beitragen.
- Die Geometrie eines Moleküls hängt nicht von der partiellen Anordnung antibindender Molekülorbitale ab. Im Gegenteil, die Geometrie eines Moleküls wird durch die räumliche Anordnung bindender Molekülorbitale repräsentiert.
- Die antibindenden Molekülorbitale werden mit einem Sternchen (*) dargestellt, während die bindenden Molekülorbitale ohne ein Sternchen (*) dargestellt werden.
- Wenn Elektronen in antibindende Molekülorbitale gefüllt werden, destabilisiert es die Bindung zwischen zwei Atomen. Im Gegenteil, wenn Elektronen zuerst in die bindenden Molekülorbitale gefüllt werden, stabilisieren sie das Molekül, weil sie weniger Energie assoziieren als das Elektron im Mutteratom.
LESEN SIE AUCH: Unterschied zwischen Orbit und Orbitalen
Bindung vs. Antibindende Molekülorbitale in Tabellenform
| VERGLEICHSGRUNDLAGE | VERBINDUNG VON MOLEKULARORBITALEN | ANTIBINDENDE MOLEKULARORBITALE |
| Beschreibung | Bindende Molekülorbitale können als eine Art von Molekülorbitalen beschrieben werden, die an der Bildung einer chemischen Bindung beteiligt sind. | Antibindende Molekülorbitale können als Orbitale beschrieben werden, die Elektronen außerhalb des Bereichs zwischen zwei Atomkernen enthalten. |
| Formation | Gebildet durch phasengleiche Kombination von Atomorbitalen. | Gebildet durch phasenverschobene Kombination von Atomorbitalen. |
| Beitrag zur Form des Moleküls | Tragen Sie direkt zur Form des Moleküls bei. | Tragen Sie nicht zur Form des Moleküls bei. |
| Gebildet, wenn | Wird gebildet, wenn die Lappen der sich verbindenden Orbitale das gleiche Vorzeichen haben. | Wird gebildet, wenn die Lappen der sich verbindenden Orbitale entgegengesetzte Vorzeichen haben. |
| Elektronendichte | Die Elektronendichte in bindenden Molekülorbitalen ist höher. | Die Elektronendichte in antibindenden Molekülorbitalen ist gering. |
| Energie | Die Energie der Bindung von Molekülorbitalen ist vergleichsweise niedriger. | Die Energie antibindender Molekülorbitale ist vergleichsweise höher. |
| Formationsbeschreibung | Gebildet durch die additive Wirkung von Atomorbitalen. | Gebildet durch den subtraktiven Effekt der Atomorbitale. |
| Stabilität | Bindende Molekülorbitale sind stabiler als sowohl antibindende Molekülorbitale als auch übergeordnete Atomorbitale. | Antibindende Molekülorbitale sind weniger stabil als sowohl bindende Molekülorbitale als auch Elternatomorbitale. |
| Molekulargeometrie | Die Geometrie eines Moleküls wird durch die räumliche Anordnung bindender Molekülorbitale dargestellt. | Die Elektronen in antibindenden Molekülorbitalen tragen nicht zur Bindungsbildung bei. |
| Sternchen-Markierung | Dargestellt ohne Sternchen (*). | Dargestellt mit einem Sternchen (*) |
| Wenn Elektronen gefüllt sind | Wenn Elektronen zuerst in die bindenden Molekülorbitale gefüllt werden, stabilisieren sie das Molekül, weil sie weniger Energie assoziieren als das Elektron im Mutteratom. | Wenn Elektronen in antibindende Molekülorbitale gefüllt werden, destabilisiert es die Bindung zwischen zwei Atomen. |