In der Chemie sind Anionen und Kationen beides Ionen. Ionen sind Atome oder Moleküle, die ein oder mehrere Valenzelektronen gewonnen oder verloren haben, was dem Ion eine positive oder negative Nettoladung verleiht. Daher ist der Hauptunterschied zwischen einem Kation und einem Anion die elektrische Nettoladung des Ions.
Eine negative Ladung ist das Ergebnis einer chemischen Spezies, die mehr Elektronen als Protonen hat, während eine positive Ladung das Ergebnis einer chemischen Spezies ist, die mehr Protonen als Elektronen hat. Normalerweise bestimmt die Anzahl der Neutronen das Isotop eines Elements, aber in keiner Weise die elektrische Ladung. Folglich können Kationen als Ionen mit einer positiven Nettoladung beschrieben werden, während Anionen als Ionen mit einer negativen Nettoladung beschrieben werden können.
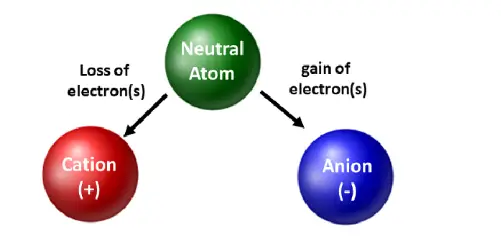
Beispiele für Kationen sind:
- Silber (Ag + )
- Hydronium (H3O + )
- Ammonium (NH 4 + )
- Kalzium (Ca 2+ )
- Magnesium (Mg 2+ )
- Aluminium (Al 3+ )
- Wasserstoff (H + )
- Kalium (K + )
- Eisen (II) (Fe2+)
- Eisen (III) Fe3+
- Barium (Ba2+)
- Ableitung II (Pb2+)
- Beryllium (Be2+) usw.
Beispiele für Anionen sind:
- Hydroxidanion (OHˉ)
- Oxidanion (O 2- )
- Sulfatanion (SO 4 2- )
- Fluorid (F-)
- Bromid (Br-)
- Jodid (I-)
- Nitrid (N3-)
- Hydrid (H-)
- Chlorid (Cl-) usw.
Was Sie über Kationen wissen müssen (Eigenschaften)
- Ein Kation ist ein positiv geladenes Ion, das aus der Freisetzung eines oder mehrerer Elektronen aus seiner Hülle resultiert, um die Stabilität zu erhöhen.
- Ein Kation hat mehr Protonen als Elektronen, ein Faktor, der ihm eine positive Nettoladung verleiht.
- Sie werden normalerweise von Metallatomen gebildet.
- Sie entstehen, wenn ein Metall seine Elektronen verliert. Sie verlieren ein oder mehr als ein Elektron und keine Protonen.
- Eine positive Nettoladung (Kation) wird mit einem hochgestellten + (positiv) nach der chemischen Formel angezeigt, z. B. Ca 2+
- Während des Elektrolyseprozesses bewegt sich das Kation immer in Richtung der Kathode, die die negative Ladung erzeugt.
- Kationen gehen elektrostatische Wechselwirkungen mit Anionen ein, um ionische Verbindungen zu bilden.
- Bei Verwendung des Periodensystems kann die Position eines Atoms im Periodensystem verwendet werden, um vorherzusagen, ob es Kationen bildet. Alkalimetalle, die meisten anderen Metalle (zB Eisen, Silber, Nickel) und Erdalkalimetalle bilden immer Kationen.
- Beim Schreiben der Formel einer Verbindung wird das Kation vor dem Anion aufgeführt. Zum Beispiel MgCl, NaCl, CaSO4, FeCl usw.
Was Sie über Anionen wissen müssen (Eigenschaften)
- Ein Anion ist ein negativ geladenes Ion, das aus der Aufnahme eines oder mehrerer Elektronen in seine Schalen resultiert, um die Stabilität zu erhöhen.
- Ein Anion hat mehr Elektronen als Protonen, ein Faktor, der ihm eine negative Nettoladung verleiht.
- Sie werden normalerweise von Metallatomen gebildet.
- Sie entstehen, wenn Nichtmetalle die Elektronen aufnehmen. Sie gewinnen ein oder mehrere Elektronen und verlieren keine Protonen.
- Eine negative Ladung (Anion) wird mit einem hochgestellten – (negativ) nach der chemischen Formel angezeigt, z. B. OHˉ.
- Während des Elektrolyseprozesses bewegt sich das Anion immer in Richtung der Anode, die die positive Ladung erzeugt.
- Anionen gehen elektrostatische Wechselwirkungen mit Kationen ein, um ionische Verbindungen zu bilden.
- Bei Verwendung des Periodensystems kann die Position eines Atoms im Periodensystem verwendet werden, um vorherzusagen, ob es Anionen bilden wird. Halogene und die meisten Nichtmetalle (zB Sauerstoff, Kohlenstoff und Schwefel) bilden immer Anionen.
- Beim Schreiben der Formel einer Verbindung wird das Kation vor dem Anion aufgeführt. Zum Beispiel MgCl, NaCl, CaSO4, FeCl usw.
Unterschied zwischen Kation und Anion in Tabellenform
| VERGLEICHSGRUNDLAGE | KATION | ANION |
| Beschreibung | Ein Kation ist ein positiv geladenes Ion, das aus der Freisetzung eines oder mehrerer Elektronen aus seiner Hülle resultiert, um die Stabilität zu erhöhen. | Ein Anion ist ein negativ geladenes Ion, das aus der Aufnahme eines oder mehrerer Elektronen in seine Schalen resultiert, um die Stabilität zu erhöhen. |
| Elektronen vs. Protonen | Es hat mehr Protonen als Elektronen, ein Faktor, der ihm eine positive Nettoladung verleiht. | Es hat mehr Elektronen als Protonen, ein Faktor, der ihm eine negative Nettoladung verleiht. |
| Formation | Sie werden normalerweise von Metallatomen gebildet. | Sie werden normalerweise von Metallatomen gebildet. |
| Wie es entsteht | Sie entstehen, wenn ein Metall seine Elektronen verliert. | Sie entstehen, wenn Nichtmetalle die Elektronen aufnehmen. |
| Ladeanzeige | Eine positive Nettoladung (Kation) wird mit einem hochgestellten + (positiv) nach der chemischen Formel angezeigt, z. B. Ca 2+ | Eine negative Ladung (Anion) wird mit einem hochgestellten – (negativ) nach der chemischen Formel angezeigt, z. B. OHˉ. |
| Während der Elektrolyse | Während des Elektrolyseprozesses bewegt sich das Kation immer in Richtung der Kathode, die die negative Ladung erzeugt. | Während des Elektrolyseprozesses bewegt sich das Anion immer in Richtung der Anode, die die positive Ladung erzeugt. |
| Elektrostatische Wechselwirkungen | Kationen gehen elektrostatische Wechselwirkungen mit Anionen ein, um ionische Verbindungen zu bilden. | Anionen gehen elektrostatische Wechselwirkungen mit Kationen ein, um ionische Verbindungen zu bilden. |
| Beispiele | Beispiele für Kationen sind: Silber (Ag + ) Hydronium (H3O + ) Ammonium (NH 4 + ) Calcium (Ca 2+ ) Magnesium (Mg 2+ ) usw. | Beispiele für Anionen sind: Hydroxidanion (OHˉ) Oxidanion (O 2 – ) Sulfatanion (SO 4 2 – ) Fluorid (F-) Bromid (Br-) Iodid (I-) Nitrid (N3-) Hydrid (H-) usw. |
| Prädikation des Periodensystems | Bei Verwendung des Periodensystems kann die Position eines Atoms im Periodensystem verwendet werden, um vorherzusagen, ob es Kationen bildet. Alkalimetalle, die meisten anderen Metalle (zB Eisen, Silber, Nickel) und Erdalkalimetalle bilden immer Kationen. | Bei Verwendung des Periodensystems kann die Position eines Atoms im Periodensystem verwendet werden, um vorherzusagen, ob es Anionen bilden wird. Halogene und die meisten Nichtmetalle (zB Sauerstoff, Kohlenstoff und Schwefel) bilden immer Anionen. |
| Formel der Verbindung schreiben | Beim Schreiben der Formel einer Verbindung wird das Kation vor dem Anion aufgeführt. Zum Beispiel MgCl, NaCl, CaSO4, FeCl usw. | Beim Schreiben der Formel einer Verbindung wird das Kation vor dem Anion aufgeführt. Zum Beispiel MgCl, NaCl, CaSO4, FeCl usw. |
