Die molekulare Geometrie in der Chemie ist die dreidimensionale Anordnung von Atomen, die ein Molekül bilden. Es umfasst die allgemeine Form des Moleküls sowie Bindungslängen, Bindungswinkel, Torsionswinkel und alle anderen geometrischen Parameter, die die Position jedes Atoms bestimmen.
Das Verständnis der molekularen Struktur einer Verbindung kann helfen, Polarität, Reaktivität, Phase der Materie, Farbe, Magnetismus sowie die biologische Aktivität zu bestimmen. Molekülgeometrien berücksichtigen die Anzahl der Atome und die Anzahl der einsamen Elektronenpaare. Gängige Molekülgeometrien umfassen:
- Linear
- Trigonal
- Tetraeder
- Oktaeder
Molekülgeometrien werden durch die Valence-Shell-Elektronenabstoßungstheorie (VSEPR) bestimmt. Dies ist eine Theorie, die die Geometrie eines Moleküls basierend auf der Minimierung der Abstoßung zwischen Elektronenpaaren vorschlägt. Dieses Modell ist für die meisten Verbindungen mit einem Zentralatom nützlich. Eine Geometrietabelle unter Verwendung der VSEPR-Theorie kann das Zeichnen und das Verständnis von Molekülen erleichtern.
Elektronen, ob gebunden oder in einsamen Paaren, stoßen sich gegenseitig ab und ordnen sich so um ein Zentralatom an, dass diese Abstoßung minimiert und der Abstand zwischen ihnen maximiert wird. Einsame Elektronenpaare werden stärker abgestoßen als gebundene, und dies ändert die Bindungswinkel in der Molekülgeometrie, wodurch die Winkel etwas kleiner werden.
Trigonal Planar
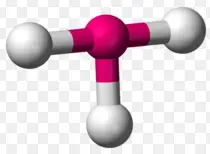
Trigonal planar ist eine molekulare Form, die entsteht, wenn drei Bindungen und keine freien Paare um das Zentralatom im Molekül vorhanden sind. In einer idealen trigonalen planaren Spezies sind alle drei Liganden identisch und die Paare sind entlang des Äquators des Zentralatoms mit einem Bindungswinkel von 120 o zwischen ihnen angeordnet. Moleküle mit trigonaler planarer Elektronenpaargeometrie weisen eine sp2d-Hybridisierung am Zentralatom auf.
Beispiele für Moleküle mit trigonaler planarer Geometrie sind:
- Bortrifluorid (BF 3 )
- Formaldehyd (H 2 CO)
- Phosgen (COCl 2 )
- Schwefeltrioxid (SO 3 )
Ionen mit trigonaler planarer Geometrie umfassen:
- Nitrat (NO 3 -)
- Karbonat (CO 3 2- )
- Guanidinium (C(NH 2 ) 3 + )
Was Sie über Trigonal Planar wissen müssen
- Trigonal-planare Geometrie wird durch Moleküle mit vier Atomen gezeigt. Es gibt ein Zentralatom und die anderen drei Atome (periphere Atome) sind so mit dem Zentralatom verbunden, dass sie in den Ecken eines Dreiecks liegen.
- Im Trigonalplanar fehlt das einsame Elektronenpaar im Zentralatom.
- Moleküle mit der trigonalen planaren Form sind dreieckig und in einer Ebene oder flachen Oberfläche.
- Ein Molekül mit einer idealen trigonal-planaren Geometrie hat einen Winkel von 120 o zwischen den peripheren Atomen.
- Beispiele für Atome, die eine trigonale planare Geometrie aufweisen, umfassen Bortrifluorid (BF), COCL 2 , Carbonate, Sulfate usw.
- In trigonal planar gibt es nur Bindungs-Bindungs-Abstoßung.
Trigonal pyramidenförmig
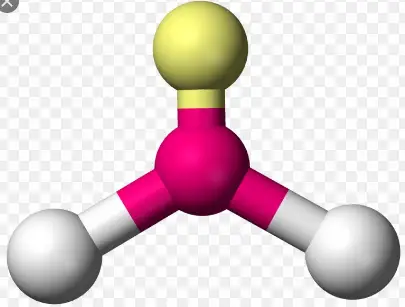
Trigonal pyramidal ist eine molekulare Form, die entsteht, wenn drei Bindungen und ein einsames Paar am Zentralatom des Moleküls vorhanden sind. In der organischen Chemie werden Moleküle mit einer trigonal-pyramidalen Geometrie manchmal als sp3 bezeichnet. Ammoniak (NH 3 ) ist ein trigonal-pyramidales Molekül. Es hat drei Wasserstoffatome und das ungeteilte Elektronenpaar, das an das Stickstoffatom gebunden ist.
Die drei Wasserstoffatome werden vom einsamen Elektronenpaar so abgestoßen, dass die Geometrie zu einer trigonalen Pyramide verzerrt wird, sodass die drei Wasserstoffatome und das einsame Elektronenpaar bei einem Bindungswinkel von fast 109 o so weit wie möglich voneinander entfernt sind .
Beispiele für Atome, die eine trigonal-pyramidale Geometrie aufweisen, sind:
- Ammoniak (NH 3 )
- Chloration (CIO 3 – )
- Sulfit-Ion (SO 3 2- )
- Pniktogenhydride (XH 3 )
- Xenontrioxid (XeO 3 )
Was Sie über Trigonal Pyramidal wissen müssen
- Trigonale Pyramidengeometrie wird durch Moleküle mit vier Atomen oder Liganden gezeigt. Zentralatome befinden sich an der Spitze und drei andere Atome oder Liganden befinden sich an einer Basis, wo sie sich in den drei Ecken eines Dreiecks befinden.
- Bei Trigonal-Pyramiden gibt es ein einsames Elektronenpaar am Zentralatom.
- Atome in Trigonal-Pyramiden liegen nicht in einer Ebene.
- Bei Trigonal-Pyramidal werden die gebundenen drei Atome und das einsame Elektronenpaar aufgrund der Bindungsabstoßung so weit wie möglich voneinander entfernt. Der Winkel zwischen den Atomen wird geringer sein als der Winkel eines Tetraeders (109 o ). Normalerweise beträgt der Winkel bei einer trigonalen Pyramide etwa 107 o .
- Beispiele für Atome, die eine trigonal-pyramidale Geometrie aufweisen, umfassen Ammoniak, Chlorationen und Sulfitionen.
- Bei Trigonal-Pyramiden gibt es Bindungsbindungen und Bindungs-Einzelnen-Paar-Abstoßung.
Lesen Sie auch: Unterschied zwischen SN1- und SN2-Reaktion
Unterschied zwischen trigonal-planar und trigonal-pyramidal in Tabellenform
| VERGLEICHSGRUNDLAGE | TRIGONAL PLANAR | TRIGONAL PYRAMIDENFÖRMIG |
| Beschreibung | Trigonal-planare Geometrie wird durch Moleküle mit vier Atomen gezeigt. Es gibt ein Zentralatom und die anderen drei Atome (periphere Atome) sind so mit dem Zentralatom verbunden, dass sie in den Ecken eines Dreiecks liegen. | Trigonale Pyramidengeometrie wird durch Moleküle mit vier Atomen oder Liganden gezeigt. Zentralatome befinden sich an der Spitze und drei andere Atome oder Liganden befinden sich an einer Basis, wo sie sich in den drei Ecken eines Dreiecks befinden. |
| Einsame Elektronenpaare | Im Zentralatom fehlen einsame Elektronenpaare. | Am Zentralatom ist ein einsames Elektronenpaar vorhanden. |
| Ein Flugzeug | Moleküle mit der trigonalen planaren Form sind dreieckig und in einer Ebene oder flachen Oberfläche. | Atome in Trigonal-Pyramiden liegen nicht in einer Ebene. |
| Bindungswinkel | Ein Molekül mit einer idealen trigonal-planaren Geometrie hat einen Winkel von 120 o zwischen den peripheren Atomen. | Der Bindungswinkel in einer Trigonal-Pyramide beträgt etwa 107 o . |
| Beispiele | Bortrifluorid (BF), COCL 2 , Carbonate, Sulfate etc. | Ammoniak, Chlorationen und Sulfitionen. |
| Bindungsabstoßung | Es gibt nur Bindungs-Bindungs-Abstoßung. | Es gibt Bindungsbindung und Bindungs-Einzelnen-Paar-Abstoßung. |