Kohlenwasserstoffe sind Verbindungen, die ausschließlich aus Kohlenstoff- und Wasserstoffatomen bestehen. Die einzigartige Natur des Kohlenstoffs stellt sicher, dass er eine starke kovalente Bindung mit Wasserstoff teilt. Da Kohlenstoffatome relativ leicht lange Ketten bilden, können Kohlenwasserstoffe sehr große Moleküle sein, die sogar Hunderte von Atomen verbinden. Beispiele für Kohlenwasserstoffe sind Erdgas, Kohle, Benzin, fossile Brennstoffe, Speiseöl und sogar Butter.
Kohlenwasserstoffe werden grob in zwei Typen eingeteilt, nämlich gesättigt und ungesättigt . Gesättigte Kohlenwasserstoffe haben eine Einfachbindung zwischen ihren Atomen. Das bedeutet, dass sich zwei beliebige Atome der Verbindung nur ein Elektronenpaar teilen. Ungesättigte Kohlenwasserstoffe können Doppel- oder Dreifachbindungen aufweisen.
Was sind Alkane?
Alkane sind organische Verbindungen, die vollständig aus einfach gebundenen Kohlenstoff- und Wasserstoffatomen bestehen und keine anderen funktionellen Gruppen aufweisen. Mit anderen Worten, ein Alkan besteht aus Wasserstoff- und Kohlenstoffatomen, die in einer baumartigen Struktur angeordnet sind, in der alle Kohlenstoff-Kohlenstoff-Bindungen einfach sind. Alkane haben die allgemeine Formel C n H 2n+2 und lassen sich in die folgenden drei Gruppen unterteilen: die linearen geradkettigen Alkane, verzweigten Alkane und Cycloalkane.
Alkane haben die allgemeine Formel C n H 2n+2. Zum Beispiel hat ein Alkan mit 2(n) Kohlenstoffatomen 6 (2n+2) Wasserstoffatome. Ihre benachbarten Atome sind durch Sigma-Bindungen verbunden und bilden tetraedrische Zentren um die Kohlenstoffatome. Da diese Bindungen alle Einfachbindungen sind, gibt es freie Rotation um alle Verbindungen. Jedes Kohlenstoffatom hat vier Bindungen (entweder CH oder CC) und jedes Wasserstoffatom ist mit einem Kohlenstoffatom verbunden (HC-Bindungen). Eine Reihe von verbundenen Kohlenstoffatomen wird als Kohlenstoffgerüst oder Kohlenstoffrückgrat bezeichnet.
Beispiele für Alkane sind:
- Methan (CH4)
- Ethan (C2H6)
- Propan (C3H8)
- Butan (C4H10)
- Pentan (C5H12)
- Hexan (C6H14)
Struktur von Alkan
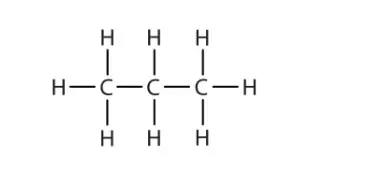
Eigenschaften von Alkanen
- Alkane sind organische Verbindungen, die vollständig aus einfach gebundenen Kohlenstoff- und Wasserstoffatomen bestehen und keine anderen funktionellen Gruppen aufweisen.
- Alkane haben die allgemeine Formel C n H 2n+2
- Sie lassen sich in drei Gruppen unterteilen: die linearen geradkettigen Alkane, die verzweigten Alkane und die Cycloalkane.
- Alkane sind typischerweise farblos. Alkane mit 5 Kohlenstoffatomen bis etwa 19 sind farblose Flüssigkeiten, während solche mit mehr als 20 Kohlenstoffatomen farblose, wachsartige Feststoffe sind.
- Die Alkane können als Gase, Flüssigkeiten oder Feststoffe bei Standardumgebungstemperatur und -druck vorliegen.
- Aufgrund des sehr geringen Unterschieds der Elektronegativität zwischen Kohlenstoff und Wasserstoff und der kovalenten Natur der CC- oder CH-Bindung sind Alkane im Allgemeinen unpolare Moleküle.
- Alkane sind im Allgemeinen in polaren Lösungsmitteln wie Wasser unlöslich, aber in unpolaren Lösungsmitteln leicht löslich.
- Der Schmelz- und Siedepunkt der kürzerkettigen Alkane ist niedrig, aber der Schmelz- und Siedepunkt der Alkane nimmt mit der Anzahl der Kohlenstoffatome in der Kohlenstoffkette zu.
- Alkane sind relativ unreaktiv. Sie reagieren nicht mit starken Säuren, Basen, Oxidations- oder Reduktionsmitteln.
- Alkane reagieren schnell mit Sauerstoff unter Freisetzung von Energie, was Alkane als Brennstoffe nützlich macht.
- Alkane reagieren mit Halogenen wie Chlorgas und Bromwasser in Gegenwart von ultraviolettem Licht.
- Alkane leiten weder Elektrizität noch werden sie durch ein elektrisches Feld wesentlich polarisiert.
- Die Dichte der Alkane nimmt normalerweise mit der Zahl der Kohlenstoffatome zu, bleibt aber immer geringer als die von Wasser.
- Alkane reagieren mit Wasserdampf in Gegenwart von Nickel zu Wasserstoff.
Was sind Alkene?
Alkene sind eine ungesättigte Form von Kohlenwasserstoffen, die durch Doppelbindungen zwischen den Kohlenstoffatomen gebildet werden. In ihrer Struktur (C=C) gibt es mindestens eine solche Doppelbindung . Alkene werden im Allgemeinen durch Eliminierungsreaktionen hergestellt, bei denen zwei Atome an benachbarten Kohlenstoffatomen entfernt werden, was zur Bildung einer Doppelbindung führt. Zubereitungen umfassen die Dehydratisierung von Alkoholen, die Dehydrierung von Alkylhalogeniden und die Dehalogenierung von Alkanen.
Viele der physikalischen Eigenschaften von Alkenen und Alkanen sind ähnlich: Sie sind farblos, unpolar und brennbar. Alkene kommen natürlicherweise in allen drei Staaten vor. Die ersten drei Alkene sind Gase und die nächsten vierzehn sind Flüssigkeiten. Höhere Alkene als diese sind alle Feststoffe. Auch der Schmelzpunkt der Feststoffe steigt mit zunehmender Molekularmasse.
Alkene haben im Allgemeinen stärkere Gerüche als ihre entsprechenden Alkane. Ethylen hat einen süßen und muffigen Geruch. Alkene sind relativ stabile Verbindungen, aber reaktiver als Alkane, entweder aufgrund der Reaktivität der Kohlenstoff-Kohlenstoff-Doppelbindung oder der Anwesenheit allylischer CH-Zentren.
Beispiele für Alkene umfassen:
- Ethen (C 2 H 4 )
- Propen (C 3 H 6 )
- Buten (C 4 H 8 )
- Penten (C 5 H 10 )
- Hexan (C 6 H 12 )
Struktur von Alken
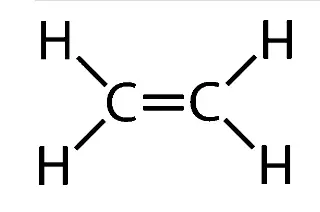
Eigenschaften von Alkenen
- Alkene sind eine ungesättigte Form von Kohlenwasserstoffen, die durch Doppelbindungen zwischen den Kohlenstoffatomen gebildet werden. In ihrer Struktur (C=C) gibt es mindestens eine solche Doppelbindung .
- Die allgemeine Formel für Alkene im Fall einer nicht-cyclischen Verbindung ist C n H 2n .
- Alkene sind aufgrund des Vorhandenseins einer Doppelbindung reaktiver als Alkane.
- Alkene kommen natürlicherweise in allen drei Staaten vor. Die ersten drei Alkene sind Gase und die nächsten vierzehn sind Flüssigkeiten. Höhere Alkene als diese sind alle Feststoffe.
- Alkene sind in Wasser unlöslich, aber in organischen Lösungsmitteln wie Aceton oder Benzol leicht löslich.
- Die Siedepunkte von Alkenen hängen von ihrer Molekülstruktur ab. Je größer ihre Molekülkette, desto höher die Siedepunkte.
- Die Polarität von Alkenen hängt von ihrer funktionellen Gruppe ab.
- Alkene haben im Allgemeinen stärkere Gerüche als ihre entsprechenden Alkane.
- Alkene können durch Eliminierungsreaktionen mit Alkanolen oder Halogenalkanen hergestellt oder synthetisiert werden.
- Alkene werden bei Sauerstoffüberschuss vollständig verbrannt und bei begrenzter Sauerstoffzufuhr unvollständig.
- Alkene gehen Additionsreaktionen mit Wasserstoff, Halogenen, Halogenwasserstoffen und Wasser ein.
Lesen Sie auch: Unterschied zwischen ionischen und kovalenten Bindungen
Was sind Alkine?
Ein Alkin ist ein ungesättigter Kohlenwasserstoff, der mindestens eine Kohlenstoff-Kohlenstoff-Dreifachbindung enthält. Die einfachsten acyclischen Alkine mit nur einer Dreifachbindung und keiner weiteren funktionellen Gruppe bilden eine homologe Reihe mit der allgemeinen chemischen Formel C n H 2n-2 . Da es sich auch um einen ungesättigten Kohlenwasserstoff handelt, ähneln einige seiner Eigenschaften Alkenen.
Die ersten drei Alkine sind Gase, die nächsten acht Flüssigkeiten. Alle Alkine, die höher als diese elf sind, sind Feststoffe. Der Siede- und Schmelzpunkt von Alkinen steigt mit zunehmender Molekülstruktur. Der Siedepunkt steigt mit Zunahme ihrer Molekularmasse. Außerdem ist der Siedepunkt von Alkinen aufgrund der einen zusätzlichen Bindung an der Kohlenstoffstelle etwas höher als der ihrer entsprechenden Alkene.
Alkine sind im Allgemeinen unpolare Moleküle mit geringer Löslichkeit in polaren Lösungsmitteln wie Wasser. Sie sind in unpolaren Lösungsmitteln wie Ether und Aceton gut löslich. Auch die Acidität dieser dreifach gebundenen Verbindungen ist größer als die Acidität von Alkanen und Alkenen. Beispiele für Alkine sind:
- Acetylen (Ethin) – C 2 H 2
- Propin (C 3 H 4 )
- Butin (C4H6)
- Pentyn (C5H8)
- Hexin (C 6 H 10 )
Struktur von Alkin
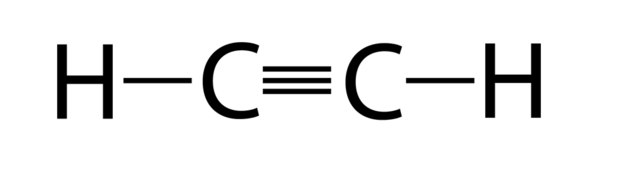
Eigenschaften von Alkinen
- Alkine sind ungesättigter Kohlenstoff, der eine Dreifachbindung an der Kohlenstoffstelle teilt .
- Die allgemeine Formel für Alkine im Fall einer nicht-cyclischen Verbindung ist C n H 2n-2 .
- Die ersten drei Alkine sind Gase, während diejenigen mit fünf bis dreizehn Kohlenstoffatomen Flüssigkeiten sind und höhere Alkine Feststoffe sind.
- Alle Alkine sind geruchs- und farblos, mit Ausnahme von Ethylen, das eine leicht ausgeprägte Farbe hat.
- Die Schmelz- und Siedepunkte von Alkinen sind recht niedrig und steigen regelmäßig mit Zunahme der Molekularmasse an. Alkine sind weniger flüchtig als Alkane und Alkene.
- Alkine sind in Wasser unlöslich, aber in organischen Lösungsmitteln wie Benzol, Hexan, Ether, Tetrachlorkohlenstoff usw. löslich.
- Alle Alkine sind leichter als Wasser. Ihre Dichten nehmen mit zunehmender Molekularmasse regelmäßig zu.
- Die Siedepunkte von Alkinen sind aufgrund einer zusätzlichen Bindung an der Kohlenstoffstelle etwas höher als die ihrer entsprechenden Alkene.
- Alkine sind von Natur aus schwach elektronegativ. Die dreifach gebundenen Kohlenstoffatome in Alkinen sind sp-hybridisiert.
- Alkine reagieren mit starken Basen wie Natrium und Sodamid zu Natriumalkinid unter Freisetzung von Diwasserstoffgas. Bei Alkanen und Alkenen tritt eine solche Reaktion nicht auf.
- Unter Standardbedingungen (Temperatur und Druck) gehen Alkine relativ leicht Hydratationsreaktionen ein.
- Alkine sind saurer als Alkane und Alkene.
- Wenn ein Alkin mit Brom umgesetzt wird, verschwindet die rotbraune Farbe von Brom.
- Alkine gehen auch Polymerisationsreaktionen ein. Zum Beispiel lineare Polymerisation von Ethin unter geeigneten Bedingungen, um Polyacetylen (Polyethin) mit der Formel –(C 2 H 2 )n- herzustellen .
Lesen Sie auch: Unterschied zwischen aliphatischer und aromatischer Verbindung
Unterschied zwischen Alkan, Alken und Alkin in Tabellenform
| VERGLEICHSGRUNDLAGE | ALKANES | ALKENE | ALKYNES |
| Beschreibung | Alkane sind organische Verbindungen, die vollständig aus einfach gebundenen Kohlenstoff- und Wasserstoffatomen bestehen und keine anderen funktionellen Gruppen aufweisen. | Alkine sind ungesättigter Kohlenstoff, der eine Doppelbindung an der Kohlenstoffstelle teilt . | Alkine sind ungesättigter Kohlenstoff, der eine Dreifachbindung an der Kohlenstoffstelle teilt . |
| Alternativer Name | Auch als Paraffin bezeichnet. | Auch als Olefin bezeichnet. | Auch als Acetylen bezeichnet. |
| Sättigung | Gesättigte Kohlenwasserstoffe. | Ungesättigte Kohlenwasserstoffe. | Ungesättigte Kohlenwasserstoffe. |
| Allgemeine Formeln | C n H 2n+2 | C n H 2n . | C n H 2n-2 . |
| Kohlenstoffbindungen | Einzel (-C) | Doppel (C=C) | Dreifach (-C=) |
| Stabilität | Stabilster Kohlenwasserstoff. | Weniger stabiler Kohlenwasserstoff als Alkan. | Weniger stabiler Kohlenwasserstoff als Alken. |
| Zustand bei Raumtemperatur und Druck | Fest, flüssig und gasförmig | Fest, flüssig und gasförmig | Fest, flüssig und gasförmig |
| Reaktion | Durchläuft eine Substitutionsreaktion. | Durchläuft eine Additionsreaktion. | Durchläuft eine Additionsreaktion. |
| Siedepunkt | Der Siedepunkt ist niedriger als der von Alkenen. | Der Siedepunkt ist höher als der von Alkanen. | Der Siedepunkt ist höher als der von Alkenen und Alkanen. |
| Reaktion mit KMnO4 | Bei Zugabe von wenigen Tropfen KMnO4 zu Ethan wird keine Farbänderung beobachtet. | Zugabe von wenigen Tropfen KMnO4 zu Ethen, die violette Farbe ändert sich in farblos/verblasst. | Zugabe von einigen Tropfen KMnO4 zu Ethin, die violette Farbe ändert sich in farblos/verblasst. |
| Löslichkeit | Sie sind im Allgemeinen in polaren Lösungsmitteln wie Wasser unlöslich, aber in unpolaren Lösungsmitteln leicht löslich. | Sie sind in Wasser unlöslich, aber in organischen Lösungsmitteln leicht löslich. | Sie sind in Wasser unlöslich, aber in organischen Lösungsmitteln löslich. |
| Reaktivität | Weniger reaktiv als Alkene. | Reaktiver als Alkane. | Alkine sind weniger reaktiv als Alkene. |
| Säure | Weniger sauer als Alken und Alkin. | Weniger sauer als Alkene. | Sie sind saurer als Alkane und Alkene. |
| Geruch | Geruchlos | Süßer Geruch | Geruchlos und farblos mit Ausnahme von Ethylen, das einen leichten Geruch hat. |
Lesen Sie auch: Unterschied gesättigte und ungesättigte Kohlenwasserstoffe