Nach dem Bohrschen Atommodell ist eine Umlaufbahn eine feste Kreisbahn, auf der sich Elektronen um den Atomkern drehen. Alle Atome drehen sich also besonders auf einer Umlaufbahn. Nach dem Bohr-Modell enthält die erste Schale 2 Elektronen. Allerdings Bohrs Atommodell wurde abgelehnt. Das allgemein akzeptierte Modell ist dasjenige, das Elektronen in Regionen gruppiert, die als Orbitale bezeichnet werden .
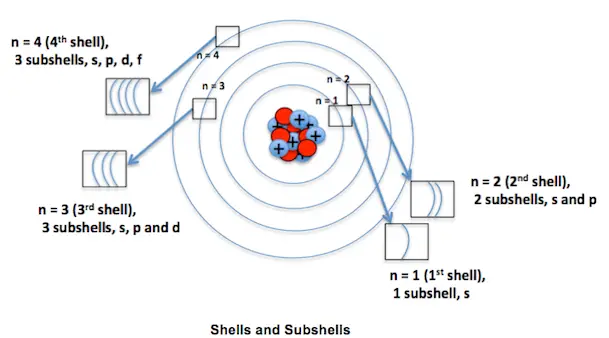
Ein Orbital wird oft als dreidimensionaler Bereich dargestellt, in dem eine Wahrscheinlichkeit von 95 Prozent besteht, ein Elektron zu finden. Orbitale können in verschiedene Typen eingeteilt werden, die häufigsten sind die S-, P-, D- und F-Orbitale. Jedes dieser Orbitale kann 2 Elektronen aufnehmen.
Atomorbitale werden oft durch eine Kombination von Zahlen und Buchstaben bezeichnet, die spezifische Eigenschaften der Elektronen repräsentieren, die mit den Orbitalen verbunden sind, zum Beispiel 1 s , 2 p , 3d, 4 f usw.
Der Unterschied
- Eine Umlaufbahn ist eine feste Kreisbahn, auf der Elektronen um den Atomkern kreisen. Im Gegensatz dazu ist ein Orbital (ein Elektronenorbital) der dreidimensionale Raum um den Kern, in dem die Wahrscheinlichkeit, Elektronen zu finden, am größten ist (90-95%).
- Eine Umlaufbahn gibt die genaue Position eines Elektrons in einem Atom an, während ein Orbital die genaue Position eines Elektrons in einem Atom nicht angibt.
- Ein Orbital repräsentiert die ebene Bewegung eines Elektrons, während ein Orbital die dreidimensionale Bewegung eines Elektrons um den Kern repräsentiert.
- Bahnen geben eine bestimmte Bahn eines Elektrons an, und dieses Konzept entspricht nicht der Heisenbergschen Unschärferelation. Ein Orbital hingegen gibt keinen bestimmten Weg an und nach diesem Konzept kann sich das Elektron überall in dieser Region befinden. Dieses Konzept entspricht dem Unschärferelationsprinzip von Heisenberg.
- Alle Bahnen sind kreisförmig, während Orbitale unterschiedliche Formen haben, zum Beispiel ist das s-Orbital kugelförmig, das p-Orbital ist kippglockenförmig.
- Eine Bahn kann als K, L, M, N usw. bezeichnet werden, während Orbitale als s, p, d, f usw. bezeichnet werden können
- Orbits haben keine Richtungseigenschaften, während alle Orbitale, außer s=Orbitale, Richtungseigenschaften haben.
- Eine Umlaufbahn kann Elektronen gleich 2n^2 aufnehmen, wobei n die Hauptquantenzahl darstellt. Andererseits kann ein Orbital nicht mehr als zwei Elektronen aufnehmen.
LESEN SIE AUCH: Unterschied zwischen der Valenzbindungstheorie (VBT) und der Molekülorbitaltheorie (MOT)
Unterschied zwischen Orbit und Orbitalen in Tabellenform
| VERGLEICHSGRUNDLAGE | ORBIT | ORBITALE |
| Beschreibung | Eine Umlaufbahn ist eine feste Kreisbahn, auf der Elektronen um den Atomkern kreisen. | Ein Orbital (ein Elektronenorbital) ist der dreidimensionale Raum um den Kern, in dem die Wahrscheinlichkeit, Elektronen zu finden, maximal ist (90-95%). |
| Position eines Elektrons in einem Atom | Eine Umlaufbahn gibt eine genaue Position eines Elektrons in einem Atom an. | Ein Orbital gibt nicht die genaue Position eines Elektrons in einem Atom an. |
| Was es darstellt | Ein Orbital repräsentiert die ebene Bewegung eines Elektrons. | Ein Orbital repräsentiert die dreidimensionale Bewegung eines Elektrons um den Kern. |
| Unschärferelation | Bahnen geben eine bestimmte Bahn eines Elektrons an, und dieses Konzept entspricht nicht der Heisenbergschen Unschärferelation. | Ein Orbital gibt keinen bestimmten Weg an und nach diesem Konzept kann sich das Elektron überall in dieser Region befinden. Dieses Konzept entspricht dem Unschärferelationsprinzip von Heisenberg. |
| Form | Alle Bahnen sind kreisförmig. | Orbitale haben unterschiedliche Formen, zum Beispiel ist das s-Orbital kugelförmig, das p-Orbital ist kippglockenförmig. |
| Bezeichnung | Ein Orbit kann als K, L, M, N usw. bezeichnet werden. | Orbitale können als s, p, d, f usw. bezeichnet werden. |
| Richtungseigenschaften | Bahnen haben keine Richtungseigenschaften. | Alle Orbitale, außer s=Orbitale, haben Richtungseigenschaften. |
| Elektronenaufnahme | Eine Umlaufbahn kann Elektronen gleich 2n^2 aufnehmen, wobei n die Hauptquantenzahl darstellt. | Ein Orbital kann nicht mehr als zwei Elektronen aufnehmen. |