Der Adsorptionsprozess erfolgt aufgrund des Vorhandenseins von unausgeglichenen oder Restkräften an der Oberfläche der flüssigen oder festen Phase. Diese unausgeglichenen Restkräfte haben die Tendenz, die molekularen Spezies, mit denen sie mit der Oberfläche in Kontakt kommen, anzuziehen und zurückzuhalten. Der Prozess der Adsorption umfasst zwei Komponenten Adsorbens und Adsorbat.
Absorption ist nach der Chemie ein physikalisches oder chemisches Phänomen oder ein Prozess, bei dem Atome, Moleküle oder Ionen in eine Volumenphase (flüssiges oder festes Material) eintreten.
Wenn sowohl Adsorption als auch Absorption gleichzeitig stattfinden, kann der Vorgang als Sorption bezeichnet werden.
Begriffsdefinitionen: Adsorbat und Adsorbens
- Adsorbens ist ein normalerweise poröser Stoff mit einer großen Oberfläche, der mit Hilfe intermolekularer Kräfte Stoffe an seine Oberfläche adsorbieren kann.
- Adsorbat ist eine Substanz, die an der Oberfläche einer anderen Substanz adsorbiert wird.
Der Unterschied
Beschreibung
Absorption ist der Prozess, bei dem Atome, Moleküle oder Ionen in eine Volumenphase einer Flüssigkeit, eines Gases oder eines Festkörpers eintreten. Die Phase, in der Moleküle absorbiert werden, wird üblicherweise als absorbierend bezeichnet.
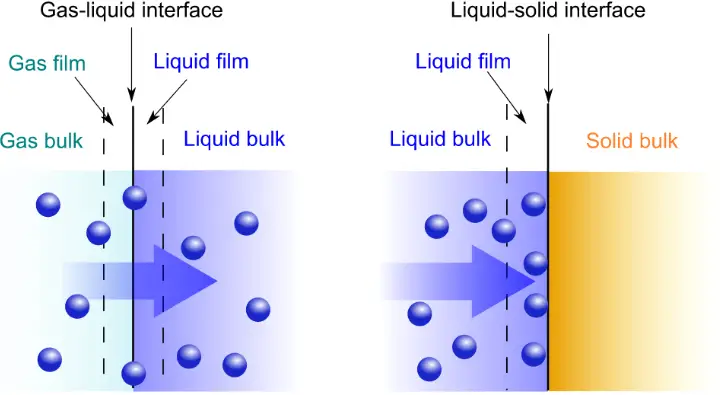
Adsorption ist das Anhaften von Atomen, Ionen oder Molekülen aus einem Gas, einer Flüssigkeit oder einem gelösten Feststoff an eine Oberfläche. Dieser Prozess erzeugt einen Adsorbatfilm auf der Oberfläche des Adsorbens.
Rate
Die Absorptionsrate behält während des gesamten Prozesses einen stabilen Zustand bei. Der stationäre Zustand wird trotz Temperaturerhöhung oder -senkung aufrechterhalten.
Die Adsorptionsrate ist in den Anfangsstadien des Prozesses normalerweise hoch, nach einigen Minuten beginnt sie zu sinken, bis das Gleichgewicht erreicht ist. Durch Temperaturerhöhung nimmt die Adsorptionsrate ab.
Typen
Die Absorption kann in zwei Arten eingeteilt werden:
Physikalische Absorption : Physikalische Absorption, bei der die absorbierten und die absorbierenden Moleküle nicht miteinander interagieren und daher die chemische Natur der Moleküle nicht stören.
Chemische Absorption : Chemische Absorption ist dabei; die absorbierten und absorbierenden Moleküle interagieren chemisch miteinander, was zur Bildung chemisch unterschiedlicher Produkte führt.
Die Adsorption hingegen kann in zwei Arten eingeteilt werden:
Chemisorption : Bei der Chemisorption werden neue chemische Bindungen zwischen dem Adsorbens und dem Adsorbat hergestellt. Normalerweise findet eine chemische Reaktion zwischen den beiden Molekülen statt.
Physisorption : Bei der Physisorption besteht nur eine Anziehungskraft zwischen dem Adsorbens und dem Adsorbat. Bei dieser Art der Adsorption sind die reagierenden Molekülspezies chemisch unverändert.
Art der ausgestellten Reaktion
Bei der Absorption ist die Reaktionsgeschwindigkeit gleichmäßig und kann als endothermer Prozess beschrieben werden. Bei der Adsorption hingegen ist die Reaktionsgeschwindigkeit konstant und erreicht ein Gleichgewicht; diese Reaktion kann als exotherme Reaktion beschrieben werden.
Auftreten
Die Absorption erfolgt nur an der Oberfläche der Phase, die mit dem Molekül in Kontakt steht. Im Gegensatz dazu tritt die Adsorption während der gesamten Phase auf, wenn Moleküle in die Phase eintreten und darin dispergiert werden.
Konzentration
Während des Absorptionsprozesses zeigt die Konzentration der absorbierten Stoffe keine signifikante Änderung. Sie bleibt über das gesamte Medium konstant.
Während des Adsorptionsprozesses ändert sich die Konzentration des adsorbierten Stoffes von der Masse zum Boden des Absorptionsmittels.
Anwendung
Das Konzept der Absorption wird in Kühllagern, Eisproduktion, Turbineneinlasskühlung und Kältemittelabsorptionskältemaschinen für Raumkühlungsanwendungen angewendet. Es wird auch bei der Hydrierung von Ölen und der Karbonisierung von Getränken verwendet. Das Konzept der Adsorption hingegen wird in der Klimatisierung, Wasserreinigung, Kunstharz, Kältemaschinen und in der Entwicklung von Antihaftbeschichtungen und in verschiedenen biomedizinischen Geräten angewendet.
Energie
Bei der Absorption werden Materialien während der gesamten Verfügbarkeit des Raums und auch aufgrund der Eigenschaften jedes Materials von anderen Materialien absorbiert.
Bei der Adsorption binden die Adsorbate an die Oberfläche des Adsorptionsmittels am häufigsten durch Van-der-Waals-Wechselwirkungen oder durch kovalente Bindungen.
Beispiele für Adsorption und Absorption
Adsorptionsbeispiele
- Als Adsorbens wird Aktivkohle oder Aktivkohle mit einem breiten Anwendungsspektrum verwendet. Es wird beispielsweise bei der Reinigung von Gasen und Wasser oder als Luftfilter in Gasmasken verwendet.
- Kieselgel ist auch ein gutes Beispiel für ein Adsorptionsmittel; es hat eine hohe Affinität zu Wasser und wird Wasser immer leichter absorbieren. Zum Beispiel wird es in vielen chromatographischen Verfahren und Techniken weit verbreitet verwendet.
- Nickel, Platin und Palladium; diese Adsorbentien werden in großem Umfang als Katalysatoren in vielen organischen Prozessen wie der Hydrierung von Ölen verwendet.
Absorptionsbeispiele
- Aufnahme von Wasser durch Schwamm.
- Aufnahme von Sauerstoff aus der Luft durch Wasser.
- Reinigung von Erdgas und anderen Petrochemikalien, wobei Gase wie Schwefelwasserstoff und Kohlendioxid in Alkanolen (Alkohol und Amin) absorbiert und eliminiert werden.
- Entfernung von Schwefelwasserstoff aus Biogas. Dabei wird zunächst Schwefelwasserstoff in Wasser aufgenommen und anschließend mit Eisenoxid behandelt.
- Absorption von Ammoniak durch Wasser.
Unterschied zwischen Absorption und Adsorption in Tabellenform
| VERGLEICHSGRUNDLAGE | ABSORPTION | ADSORPTION |
| Beschreibung | Absorption ist der Prozess, bei dem Atome, Moleküle oder Ionen in eine Volumenphase einer Flüssigkeit, eines Gases oder eines Festkörpers eintreten. Die Phase, in der Moleküle absorbiert werden, wird üblicherweise als absorbierend bezeichnet. | Adsorption ist das Anhaften von Atomen, Ionen oder Molekülen aus einem Gas, einer Flüssigkeit oder einem gelösten Feststoff an eine Oberfläche. Dieser Prozess erzeugt einen Adsorbatfilm auf der Oberfläche des Adsorbens. |
| Rate | Die Absorptionsrate behält während des gesamten Prozesses einen stabilen Zustand bei. Der stationäre Zustand wird trotz Temperaturerhöhung oder -senkung aufrechterhalten. | Die Adsorptionsrate ist in den Anfangsstadien des Prozesses normalerweise hoch, nach einigen Minuten beginnt sie zu sinken, bis das Gleichgewicht erreicht ist. Durch Temperaturerhöhung nimmt die Adsorptionsrate ab. |
| Typen | Die Absorption kann in zwei Arten eingeteilt werden: Physikalische AbsorptionChemische Absorption | Die Adsorption kann in zwei Typen eingeteilt werden: Chemisorption Physisorption |
| Art der ausgestellten Reaktion | Die Reaktionsgeschwindigkeit ist gleichmäßig und kann als endothermer Prozess beschrieben werden. | Die Reaktionsgeschwindigkeit ist konstant und erreicht ein Gleichgewicht; diese Reaktion kann als exotherme Reaktion beschrieben werden. |
| Auftreten | Die Absorption erfolgt nur an der Oberfläche der Phase, die mit dem Molekül in Kontakt steht. | Die Adsorption findet während der gesamten Phase statt, wenn Moleküle in die Phase eintreten und darin dispergiert werden. |
| Konzentration | Während des Absorptionsprozesses zeigt die Konzentration der absorbierten Stoffe keine signifikante Änderung. Sie bleibt über das gesamte Medium konstant. | Während des Adsorptionsprozesses ändert sich die Konzentration des adsorbierten Stoffes von der Masse zum Boden des Absorptionsmittels. |
| Energie | Materialien werden durch die Verfügbarkeit des Raums und auch aufgrund der Eigenschaften jedes Materials von anderen Materialien absorbiert. | Die Adsorbate binden an die Oberfläche des Adsorptionsmittels am häufigsten durch Van-der-Waals-Wechselwirkungen oder durch kovalente Bindungen. |
| Anwendung | Angewendet in Kühlhäusern, Eisproduktion, Turbineneinlasskühlung und Kältemittelabsorptionskältemaschinen für Raumkühlungsanwendungen. Es wird auch bei der Hydrierung von Ölen und der Karbonisierung von Getränken verwendet. | Anwendung in Klimaanlagen, Wasserreinigung, Kunstharz, Kühlern und in der Entwicklung von Antihaftbeschichtungen und in verschiedenen biomedizinischen Geräten. |
Zusammenfassung
Absorption ist der Prozess, bei dem Atome, Moleküle oder Ionen in eine Volumenphase einer Flüssigkeit, eines Gases oder eines Festkörpers eintreten. Die Phase, in der Moleküle absorbiert werden, wird üblicherweise als absorbierend bezeichnet.
Adsorption ist das Anhaften von Atomen, Ionen oder Molekülen aus einem Gas, einer Flüssigkeit oder einem gelösten Feststoff an eine Oberfläche. Dieser Prozess erzeugt einen Adsorbatfilm auf der Oberfläche des Adsorbens.