Gemische unterscheiden sich von reinen Substanzen wie Elementen und Verbindungen, da Gemische verschiedene Substanzen enthalten, die physikalisch, aber nicht chemisch kombiniert werden. Die einzelnen Komponenten einer Mischung behalten ihre Identität.
Es gibt zwei Arten von Gemischen: homogen und heterogen. Eine homogene Mischung hat eine einheitliche Zusammensetzung und ein einheitliches Erscheinungsbild. Einzelne Substanzen, die eine homogene Mischung bilden, können visuell nicht unterschieden werden. Andererseits umfasst eine heterogene Mischung zwei oder mehr Substanzen, die deutlich beobachtet und sogar relativ leicht getrennt werden können.
Vergleichstabelle
| Heterogen | Homogen | |
|---|---|---|
| Uniform | Nein | Ja |
| Sie können die Teile sehen | Ja | Nein |
| Kann physisch getrennt werden | Ja | Nein |
| Beispiele | Salat, Trails | Olivenöl , Stahl, Salz in Wasser |
| Chemisch gebunden | Nein | Nein |
Physikalische Eigenschaften
Alle Gemische enthalten zwei oder mehr Reinsubstanzen (Elemente oder Verbindungen). Der Unterschied zwischen einer Mischung und einer Verbindung besteht darin, wie sich die Elemente oder Substanzen zu ihnen verbinden. Verbindungen sind reine Substanzen, da sie nur eine Art von Molekül enthalten. Moleküle bestehen aus Atomen, die miteinander verbunden sind. In einem Gemisch sind jedoch sowohl Elemente als auch Verbindungen physikalisch, aber nicht chemisch vermischt – zwischen den reinen Substanzen, aus denen das Gemisch besteht, bilden sich keine atomaren Bindungen .
Unabhängig von atomaren Bindungen können Gemische jedoch ziemlich kohäsiv werden. Im Allgemeinen als Lösungen bezeichnet , sind homogene Gemische solche, bei denen sich die Substanzen so gut mischen, dass sie nicht einzeln in einer differenzierten, unterschiedlichen Form gesehen werden können. Ihre Zusammensetzung ist gleichmäßig, dh in der gesamten Mischung gleich. Diese Gleichmäßigkeit liegt daran, dass die Bestandteile eines homogenen Gemisches in jedem Teil des Gemisches im gleichen Verhältnis vorkommen.
Umgekehrt ist ein heterogenes Gemisch eines, bei dem die Bestandteile nicht gleichmäßig verteilt sind. Sie können oft visuell voneinander getrennt und sogar relativ leicht getrennt werden, obwohl es viele Methoden gibt, um auch homogene Lösungen zu trennen.
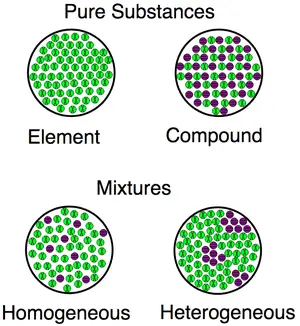
Eine Visualisierung für die Unterschiede zwischen Substanzen (Verbindungen, Elemente) und Gemischen (sowohl homogen als auch heterogen).
Beispiele für homogene und heterogene Gemische
Beispiele für heterogene Gemische wären Eiswürfel (bevor sie schmelzen) in Soda, Müsli in Milch , verschiedene Beläge auf einer Pizza, Beläge in gefrorenem Joghurt , eine Schachtel mit verschiedenen Nüssen. Sogar eine Mischung aus Öl und Wasser ist heterogen, da die Dichte von Wasser und Öl unterschiedlich ist, was eine gleichmäßige Verteilung in der Mischung verhindert.
Beispiele für homogene Mischungen sind milkshakes, blended Gemüsesaft, Zucker in gelösten Kaffee , Alkohol in Wasser, und Legierungen , wie Stahl. Sogar die Luft in unserer Atmosphäre ist eine homogene Mischung aus verschiedenen Gasen und – je nach Stadt, in der Sie leben – Schadstoffen. Viele Substanzen wie Salz und Zucker lösen sich in Wasser zu homogenen Gemischen.
Arten von Gemischen
Es gibt drei Familien von Gemischen: Lösungen, Suspensionen und Kolloide. Die Lösungen sind homogen, während Suspensionen und Kolloide heterogen sind.
Lösung
Lösungen sind homogene Gemische, die einen in einem Lösungsmittel gelösten gelösten Stoff enthalten, z. B. in Wasser gelöstes Salz. Wenn das Lösungsmittel Wasser ist, spricht man von einer wässrigen Lösung. Das Massenverhältnis des gelösten Stoffes zum Lösungsmittel wird als Konzentration der Lösung bezeichnet.
Lösungen können flüssig, gasförmig oder sogar fest sein. Darüber hinaus können die einzelnen Komponenten der Lösung unterschiedliche Materiezustände sein. Der gelöste Stoff nimmt die Phase (fest, flüssig oder gasförmig) des Lösungsmittels an, wenn das Lösungsmittel der größere Anteil der Mischung ist.
- Gasförmige Lösungen: Wenn das Lösungsmittel ein Gas ist, können nur gasförmige gelöste Stoffe darin gelöst werden. Das häufigste Beispiel für eine gasförmige Lösung ist die Luft in unserer Atmosphäre, die Stickstoff (das Lösungsmittel) ist und gelöste Stoffe wie Sauerstoff und andere Gase enthält.
- Flüssige Lösungen: Flüssige Lösungsmittel können jede Art von gelösten Stoffen lösen.
- Gas in Flüssigkeit: Beispiele sind Sauerstoff in Wasser oder Kohlendioxid in Wasser.
- Flüssigkeit in Flüssigkeit: Beispiele sind alkoholische Getränke; Sie sind Lösungen von Ethanol in Wasser.
- Fest in Flüssigkeit: Zucker- oder Salzlösungen in Wasser sind Beispiele für solche Gemische. Viele Feststoffe in flüssigen Gemischen sind nicht homogen, daher sind sie keine Lösungen. Dies können Kolloide oder Suspensionen sein .
- Feste Lösungen: Feste Lösungsmittel können auch gelöste Stoffe in jedem Materiezustand lösen.
- Gas in Feststoff: Ein Beispiel hierfür ist in Palladium gelöster Wasserstoff
- Flüssigkeit in Feststoff: Beispiele hierfür sind Quecksilber in Gold, das ein Amalgam bildet, und Wasser (Feuchtigkeit) in Salz
- Fest in Fest: Legierungen wie Stahl, Messing oder Bronze sind ein Beispiel für solche Gemische.
Suspension
Eine Suspension ist eine heterogene Mischung, die feste Partikel enthält, die groß genug für die Sedimentation sind. Die festen Partikel lösen sich nicht im Lösungsmittel, sondern sind suspendiert und frei schwebend. Sie sind größer als 1 Mikrometer und normalerweise groß genug, um mit bloßem Auge sichtbar zu sein. Ein Beispiel ist Sand in Wasser. Ein wesentliches Merkmal von Suspensionen ist, dass sich die suspendierten Partikel im Laufe der Zeit absetzen, wenn sie nicht gestört werden.
Kolloid
Kolloide sind heterogen wie Suspensionen, scheinen jedoch optisch homogen zu sein, da die Partikel in der Mischung sehr klein sind – 1 Nanometer bis 1 Mikrometer. Der Unterschied zwischen Kolloiden und Suspensionen besteht darin, dass die Partikel in Kolloiden kleiner sind und sich die Partikel im Laufe der Zeit nicht absetzen.
| Lösung | Kolloid | Suspension | |
|---|---|---|---|
| Homogenität | Homogen | Auf mikroskopischer Ebene heterogen, aber optisch homogen | Heterogen |
| Partikelgröße | <1 Nanometer (nm) | 1 nm – 1 Mikrometer (& mgr; m) | > 1 μm |
| Physisch stabil | Ja | Ja | Benötigt Stabilisierungsmittel |
| Zeigt Tyndall-Effekt | Nein | Ja | Ja |
| Trennt sich durch Zentrifuge | Nein | Ja | Ja |
| Trennt sich durch Dekantieren | Nein | Nein | Ja |
Technik
Bis zu einem gewissen Grad könnte man sagen (wenn man pedantisch wäre), dass die Frage, ob eine Mischung homogen oder heterogen ist, von der Skala abhängt, in der die Mischung beprobt wird.
Wenn der Umfang der Probenahme fein (klein) ist, kann er so klein wie ein einzelnes Molekül sein. In diesem Fall würde jede Probe heterogen werden, da sie in diesem Maßstab klar abgegrenzt werden kann. Wenn es sich bei der Probe um die gesamte Mischung handelt, können Sie sie als homogen genug betrachten.
Um praktisch zu bleiben, verwenden wir diese Faustregel, um zu entscheiden, ob eine Mischung homogen ist: Wenn die interessierende Eigenschaft der Mischung dieselbe ist, unabhängig davon, welche Probe für die verwendete Untersuchung entnommen wird, ist die Mischung homogen.
Verweise
- Mischung – Wikipedia
- Homogene und heterogene Gemische – Wikipedia