Was ist Amin?
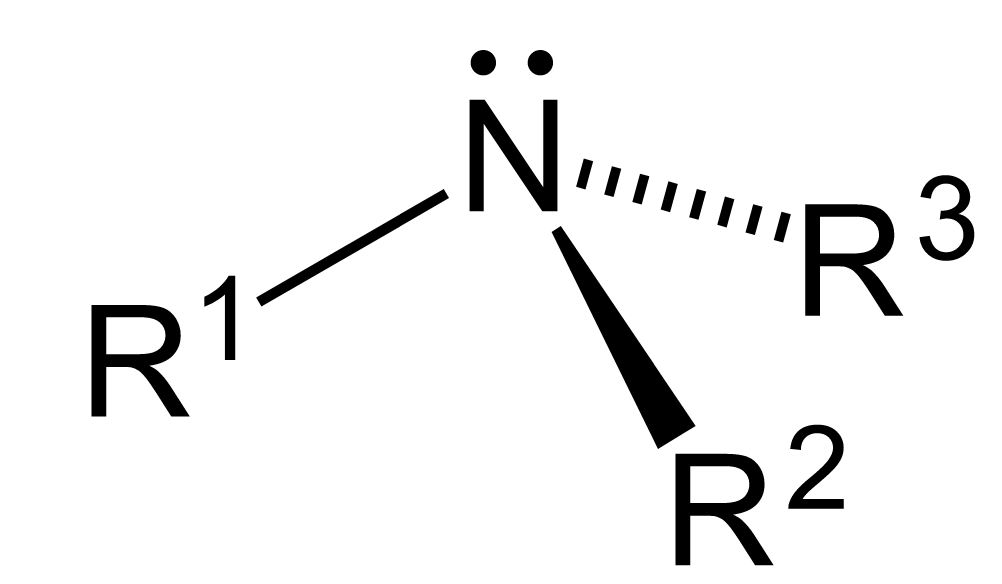
In der organischen Chemie sind Amine Verbindungen und funktionelle Gruppen, die ein basisches Stickstoffatom mit einem freien Elektronenpaar enthalten. Amine sind formal Derivate von Ammoniak, bei denen ein oder mehrere Wasserstoffatome durch einen Substituenten wie eine Alkyl- oder Arylgruppe ersetzt wurden. Manchmal werden Amine, bei denen beide Substituententypen an ein Stickstoffatom gebunden sind, als Alkylarylamine bezeichnet .
Amine können nach Art und Anzahl der Substituenten am Stickstoff klassifiziert werden, dh aliphatische Amine und aromatische Amine . Aliphatische Amine enthalten nur H- und Alkylsubstituenten, während bei aromatischen Aminen das Stickstoffatom mit einem aromatischen Ring verbunden ist.
Wichtige Amine sind Aminosäuren, Trimethylamin, Anilin und biogene Amine. Auch anorganische Derivate von Ammoniak wie Monochloramin werden auch als Amine bezeichnet.
Amine werden häufig in der Färbereiindustrie verwendet, z. B. Methylorange, Gelborange usw. Sie werden auch zur Entfernung von CO2 aus Verbrennungs- und Rauchgasen verwendet und können möglicherweise Treibhausgase reduzieren.
Was Sie über Amine wissen müssen
- Amin ist eine organische Verbindung, die aus einem oder mehreren Stickstoffatomen besteht, die an Alkylgruppen gebunden sind.
- Das Stickstoffatom in einem Amin hat ein einsames Elektronenpaar und drei Bindungen zu anderen Atomen, entweder Kohlenstoff oder Wasserstoff.
- Die Reaktion von Ammoniak mit einem Alkylhalogenid führt zur Bildung eines primären Amins. Dieses Verfahren kann als Alkylierung von Ammoniak bezeichnet werden .
- Amine werden entweder durch Hinzufügen des Präfixes ”Amino” oder des Suffixes ”Amin” vor und nach dem übergeordneten Begriff in der entsprechenden Reihenfolge benannt.
- Die Stärke von primären, sekundären und tertiären Aminen ist ziemlich ähnlich.
- Da Stickstoff eine normale Wertigkeit von drei hat, gibt es in primären Aminen zwei NH-Bindungen und in sekundären Aminen eine NH-Bindung. In tertiären Aminen gibt es keine NH-Bindungen.
- Bei Aminen haben die mit dem Stickstoff verbundenen Bindungen die Form einer abgeflachten Pyramide und daher kann die Anordnung als pyramidenförmig bezeichnet werden.
- Je nach Art der angehängten Alkylgruppe kann das Amin weiter in aliphatische Amine (Amine ohne Ringstruktur) und aromatische Amine (Amine mit Ringstruktur) eingeteilt werden.
- Die charakteristische chemische Eigenschaft von Aminen besteht darin, dass sie Basen sind. Dies liegt an der Tatsache, dass am Stickstoff ein ungeteiltes Paar vorhanden ist, was sie zu Lewis-Basen macht.
- Die Hydrolyse eines Amids erzeugt eine Carbonsäure und Ammoniak oder ein Amin.
- Der Siedepunkt von Aminen ist aufgrund des Vorhandenseins von Wasserstoffbrücken zwischen zwei Aminen sowie der Van-der-Waals-Dispersionskraft und der Dipol-Dipol-Wechselwirkungen höher als der Siedepunkt der entsprechenden Alkane.
- Im Gegensatz zu den meisten anderen organischen Verbindungen sind Amine aufgrund der Bildung von Wasserstoffbrücken zwischen Amin und Wassermolekül in Wasser löslich.
- Amine haben meist ein niedriges Molekulargewicht und liegen daher bei Raumtemperatur als Gase vor und werden leicht verdampft.
Was ist Amid?
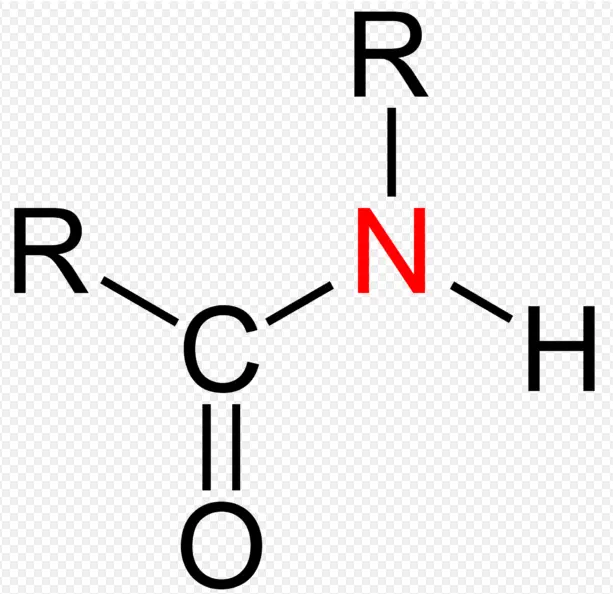
Ein Amid, auch als Säureamid bezeichnet , sind funktionelle Gruppen, in denen ein Carbonylkohlenstoffatom durch eine Einfachbindung an ein Stickstoffatom und entweder ein Wasserstoff- oder ein Kohlenstoffatom gebunden ist. Amide werden üblicherweise als Derivate von Carbonsäuren angesehen, bei denen die Hydroxylgruppe durch ein Amin oder Ammoniak ersetzt wurde. Das einsame Elektronenpaar am Stickstoff wird in Carbonyl delokalisiert, wodurch eine partielle Doppelbindung zwischen N und dem Carbonylkohlenstoff gebildet wird.
Amide können nach der Anzahl der an den Stickstoff gebundenen Kohlenstoffe in primäre Amide, sekundäre Amide und tertiäre Amide eingeteilt werden.
Amide entstehen aufgrund der strukturellen Steifigkeit bei der Herstellung von Strukturmaterialien. Andere Amide mit geringem Gewicht werden als übliche Lösungsmittel verwendet, zB Dimethylformamid. Auch viele Medikamente wie Paracetamol, Penicillin und LSD sind Amide.
Es ist wichtig zu beachten, dass Amide vergleichsweise weniger löslich sind als Amine und Carbonsäuren, da diese Verbindungen Wasserstoffbrücken sowohl abgeben als auch aufnehmen können.
Was Sie über Amid wissen müssen
- Amid ist eine organische Verbindung oder Moleküle, die Stickstoffatome enthalten, die mit dem Kohlenstoffatom der Carbonylgruppe verbunden sind.
- Die Kohlenstoff-Stickstoff – Bindung in Amid wird als Amid – Bindung . Die Anleihe kann auch als bezeichnet werden Peptidbindung in Proteinmoleküle.
- In Amiden liegen die Elektronen von drei p-Orbitalen an den drei Atomen Sauerstoff, Kohlenstoff und Stickstoff auf derselben Ebene und sind delokalisiert.
- Anders als Amide wie Methanamid, die bei Raumtemperatur flüssig sind, sind andere Amide mit höherer Kohlenstoffkette bei Raumtemperatur fest. Dies ist auf das Vorhandensein einer intermolekularen Wasserstoffbindung zwischen den teilweise positiven Wasserstoffatomen zurückzuführen, die mit Stickstoff eines Moleküls und teilweise negativ geladenen Sauerstoffatomen in einem anderen Molekül verbunden sind.
- Amide haben einen hohen Schmelzpunkt aufgrund von Wasserstoffbrückenbindungen, die zum Aufbrechen mehr Energie benötigen.
- Kurzkettige Amide sind in Wasser löslich, da sie eine Wasserstoffbrücke mit Wassermolekülen haben. Wenn die Kohlenstoffkette zunimmt, nimmt die Löslichkeit ab, da die lange Kette die Wasserstoffbrückenbindung behindert.
- Amide wirken normalerweise sowohl als Bindungsdonor als auch als -Akzeptor. Das Stickstoff- und das Sauerstoffatom fungieren als Akzeptor und das Wasserstoffatom als Donor.
- Amide können entstehen, wenn Carbonsäuren mit Aminen oder Ammoniak in einem als Amidierung bezeichneten Verfahren reagieren .
- Amide werden durch Hinzufügen des Suffixes „Amid“ nach dem übergeordneten Begriff benannt.
- Amide können nach der Anzahl der an den Stickstoff gebundenen Kohlenstoffe in primäre Amide, sekundäre Amide und tertiäre Amide eingeteilt werden.
- Beim primären Amid ist das Stickstoffatom an keine Alkylgruppe gebunden, während bei sekundären Amiden das Stickstoffatom an eine einzelne Alkylgruppe gebunden ist und schließlich das Stickstoffatom an zwei Alkylgruppen im tertiären Bereich gebunden ist.
- Im Allgemeinen widerstehen Amide der Hydrolyse in reinem Wasser, selbst nach längerem Erhitzen. In Gegenwart von zugesetzter Säure oder Base schreitet die Hydrolyse mit mäßiger Geschwindigkeit voran.
Lesen Sie auch: Unterschied zwischen Kondensation und zusätzlicher Polymerisation
Unterschied zwischen Amin und Amid in Tabellenform
| VERGLEICHSGRUNDLAGE | AMINE | AMIDE |
| Beschreibung | Amin ist eine organische Verbindung, die aus einem oder mehreren Stickstoffatomen besteht, die an Alkylgruppen gebunden sind. | Amid ist eine organische Verbindung oder Moleküle, die Stickstoffatome enthalten, die mit dem Kohlenstoffatom der Carbonylgruppe verbunden sind. |
| Benennung | Amine werden entweder durch Hinzufügen des Präfixes ”Amino” oder des Suffixes ”Amin” vor und nach dem übergeordneten Begriff in der entsprechenden Reihenfolge benannt. | Amide werden durch Hinzufügen des Suffixes „Amid“ nach dem übergeordneten Begriff benannt. |
| Carbonylgruppe | Haben keine Carbonylgruppe in ihrer Struktur. | Haben eine Carbonylgruppe in ihrer Struktur. |
| Siedepunkte | Haben relativ niedrigere Siedepunkte. | Haben relativ höhere Siedepunkte. |
| Einstufung | Kann eingeteilt werden in aliphatische Amine (Amine ohne Ringstruktur) Aromatische Amine (Amine mit Ringstruktur). | Amide können klassifiziert werden als Primäres Amid Sekundäres Amid Tertiäres Amid |
| Produktion | Die Reaktion von Ammoniak mit einem Alkylhalogenid führt zur Bildung eines primären Amins. Dieses Verfahren kann als Alkylierung von Ammoniak bezeichnet werden . | Amide können entstehen, wenn Carbonsäuren mit Aminen oder Ammoniak in einem als Amidierung bezeichneten Verfahren reagieren . |
| Löslichkeit | Amine sind in Wasser löslich, aber die Löslichkeit nimmt mit zunehmender Kettenzahl ab. | Kurzkettige Amide sind wasserlöslich; die Löslichkeit nimmt jedoch mit zunehmender Kettenzahl ab. |
| Chemische Eigenschaften | Zeigen Sie grundlegende Eigenschaften. | Säureeigenschaften zeigen. |
| Atome | Bestehend aus C-, H- und N-Atomen. | Bestehend aus C-, H- und O-Atomen. |
| Physikalischer Zustand bei Raumtemperatur | Amine mit niedrigem Molekulargewicht sind bei Raumtemperatur Gase oder werden leicht verdampft. | Die meisten Amide sind bei Raumtemperatur Feststoffe. |